Kesimpta® (ofatumumab) er er et fullstendig humant monoklonalt antistoff. Dette er den første og eneste selvadministrerte, målrettede B-celleterapibehandlingen for voksne pasienter med relapserende multippel sklerose (RMS).1

Illustrasjon: Kesimpta® (ofatumumab) kommer med en ferdigfylt penn. Der hver ferdigfylte penn inneholder 20 mg ofatumumab i en 0,4 ml oppløsning.
Nasjonalt kvalitets- og kompetansenettverk for multippel sklerose (MS) har i sitt nyhetsbrev kommet med anbefalinger for medisinske indikasjoner for bruk av Kesimpta der andre rimeligere anti-CD20 antostoff er vurdert uegnet.2
Disse er:
- Ved serumsyke etter rituksimab infusjon (feber, artralgi og utslett 1-2 uker etter infusjon) og samtidig manglende tap av CD19+ B-celler under behandling med rituksimab.
- Ved alvorlige, potensielt livstruende infusjonsreaksjoner under rituksimab behandling (kan forventes hos mindre enn 1 % av pasienter behandlet med rituksimab).
- Ved behandlingssvikt under rituksimab behandling, med nye MS-attakk og nye MRI-lesjoner med eller uten kontrastlading, oppstått etter en oppstartsperiode på 3-6 måneder. Dette kan særlig vurderes hos pasienter som i tillegg har manglende/lavt fall av CD19-positive celler 1-2 måneder etter behandling.
- Pasienter med lavt IgG (anslagsvis <= 7 g/L ) før oppstart med aCD20, og der man likevel anser aCD20 som beste behandling.
- Pasienter som under behandling med rituksimab har betydelig og vedvarende fall i IgG (anslagsvis 1-2 g/l per år over en periode på 2-3 år), og der aCD20 likevel anses som beste behandling. Som hovedregel anbefales forlenget intervall mellom rituksimabinfusjonene før bytte til ofatumumab. Grensen for hva som er betydelig fall i IgG vil avhenge av IgG-nivået før oppstart av rituksimab, og om det også er andre tegn til svekket infeksjonsforsvar som lymfopeni, nøytropeni eller infeksjonstendens.
Sikkerhet
Bivirkninger som har vært rapportert i forbindelse med bruk av ofatumumab i pivotale kliniske studier ved RMS og etter markedsføring, er oppgitt i tabell 1 i henhold til MedDRAs organklassesystem. Innen hver organklasse er bivirkninger rangert etter frekvens, med de hyppigst forekommende reaksjonene først. Innen hver frekvensgruppering er bivirkninger presentert etter synkende alvorlighetsgrad. I tillegg er de tilsvarende frekvenskategoriene for hver bivirkning basert på følgende inndeling: svært vanlige (≥ 1/10), vanlige (≥ 1/100 til < 1/10), mindre vanlige (≥ 1/1 000 til < 1/100), sjeldne (≥ 1/10 000 til < 1/1 000), svært sjeldne (< 1/10 000), ikke kjent (kan ikke anslås ut ifra tilgjengelige data).
Bivirkningstabell (SPC Kesimpta, avsnitt 4.8)

Viktig sikkerhetsinformasjon:
- Pasientene bør informeres om at systemiske injeksjonsrelaterte reaksjoner kan forekomme, vanligvis i løpet av 24 timer og hovedsakelig etter første injeksjon 1
- Det anbefales å undersøke pasientens immunstatus før behandling igangsettes. Kvinner som kan bli gravide, må bruke effektiv antikonsepsjon1
- Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Alvorlig nedsatt immunforsvar. Alvorlig aktiv infeksjon inntil bedring. Kjent aktiv malignitet1
- Hyppigste bivirkninger: Infeksjoner i øvre luftveier, systemiske injeksjonsrelaterte reaksjoner, reaksjoner på injeksjonsstedet og urinveisinfeksjoner1
Reseptgruppe, refusjon & pris: Reseptgruppe C. H-resept. Kesimpta 20 mg, 1 stk. (ferdigfylt penn). Listepris (AUP) Kr 22 101,00 per 05.09.2024. Endelig pris er rabattert. Godkjent av Beslutningsforum (ID2020_066:): Til behandling av voksne med relapserende former for multippel sklerose (RMS) med aktiv sykdom definert ved kliniske eller bildediagnostiske funn når annet, rimeligere anti-CD20 antistoff er vurdert uegnet. For mer informasjon, se felleskatalogen.no
Kesimpta® er indisert til behandling av voksne pasienter med relapserende former for multippel sklerose (RMS) med aktiv sykdom definert ved kliniske eller bildediagnostiske funn (se SPC pkt. 5.1).1
EU-kommisjonen godkjente Kesimpta® (ofatumumab) 26. mars 2021 for behandling av relapserende former av multippel sklerose (RMS) hos voksne med aktiv sykdom definert ved kliniske eller bildediagnostiske funn. Dette er den første og eneste selvadministrerte, målrettede B-celleterapibehandlingen for voksne pasienter med relapserende multippel sklerose (RMS).3
Beslutningforum for nye metoder har godkjent Kesimpta til behandling av voksne pasienter med relapserende former for multippel sklerose (RMS) med aktiv sykdom definert ved kliniske eller bildediagnostiske funn når annet, rimeligere anti-CD20 antistoff er vurdert uegnet.4
Kesimpta® administreres av pasienten selv en gang i måneden hjemme, og gis ved subkutan injeksjon med lav medisindose (20mg) via en ferdigfylt Sensoready® penn (20 mg/0.4mL).
Selvadministering med Sensoready® penn gjør at man kan behandle seg selv på mindre enn ett minutt i måneden*
*Typisk administreringstid når man er klar til å injisere. En gang per måned etter tre ukers innledende doser.
Les mer om behandling med ofatumumab ved MS beskrevet i NevroNEL (Norsk Elektronisk håndbok)
Initialt administreres Kesimpta® ved uke 0, 1 og 2, så hopper en over en uke (uke 3). Påfølgende månedlige doser, med start ved uke 4 (se figur 1). Den første injeksjonen gjøres på sykehus under veiledning av helsepersonell.
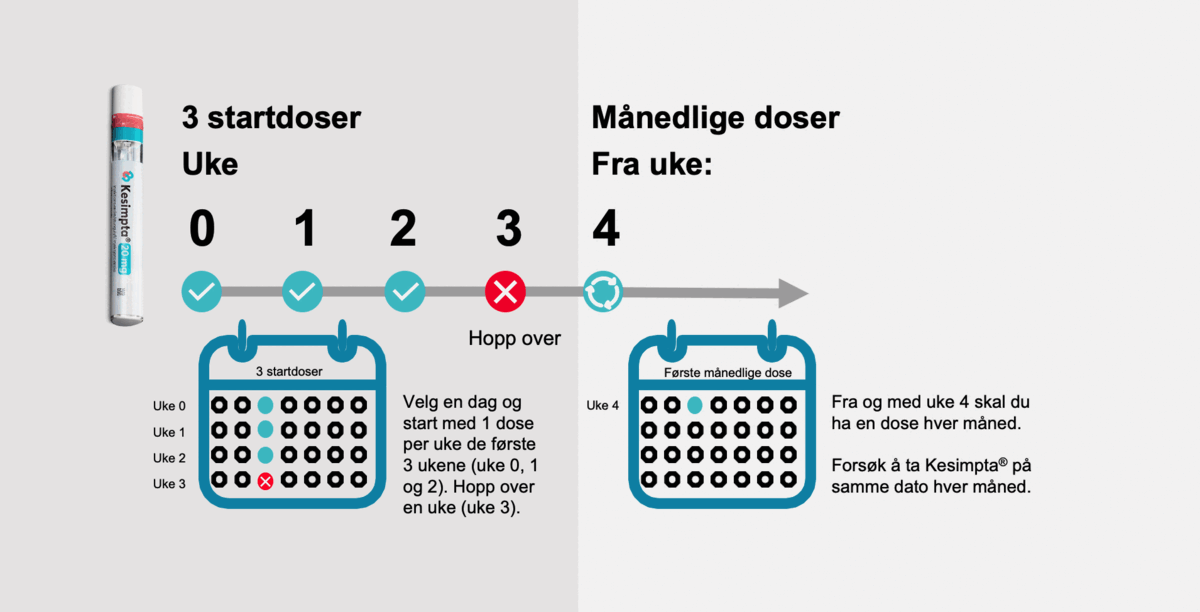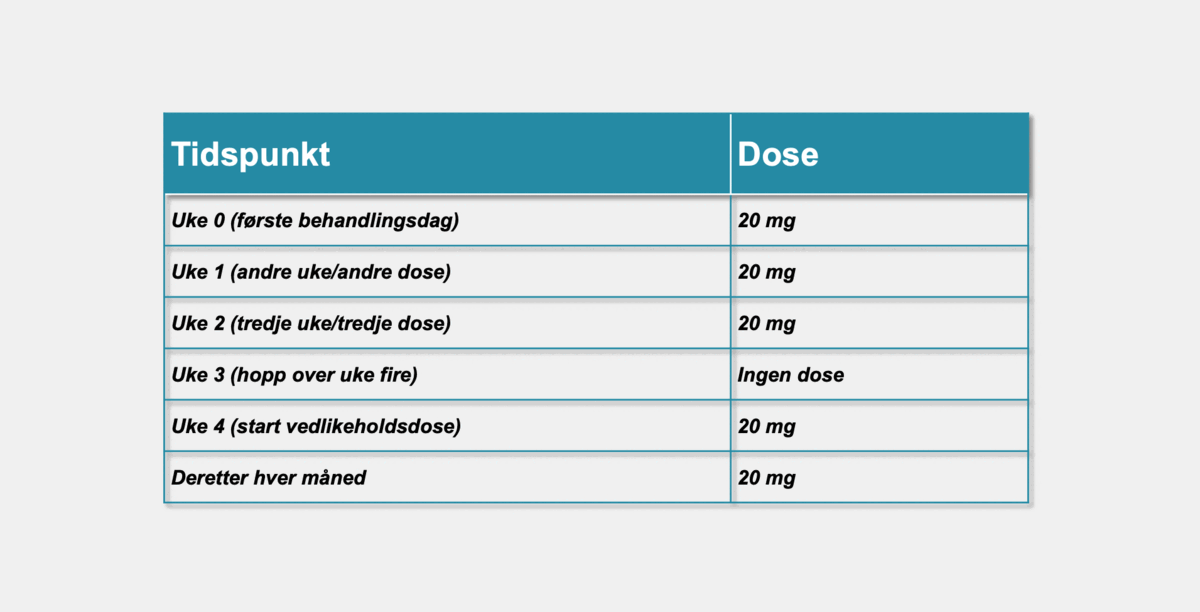
Figur 1: En tar 1 dose (20mg) administrert ved subkutan injeksjon per uke de første tre ukene: uke 0, 1 og 2, så hopper en over en uke (uke 3). Påfølgende månedlige doser etter dette, med start ved uke 4 (se SPC, pkt 4.2).1 NO2310126189

Figur 2: For ufyllende informasjon, se SPC, vedlegg B., pakningsvedlegg.1
De vanlige stedene for subkutane injeksjoner er mage, lår og ytterside av overarm (se SPC pkt. 4.2).1
Subkutan injeksjon betyr at legemiddelet injiseres inn i underhudsvevet, i motsetning til intravenøs administrasjon, hvor legemiddelet settes i en vene. Fullhumanisert betyr at legemiddelet tilsvarer det menneskelige proteinet. Tanken er at fullhumanisert B-cellepreparat er så likt det menneskelige proteinet at det derfor kan gi mindre immunreaksjoner mot selve legemiddelet.5 Å kunne dosere legemiddel med lavere dose vil potensielt redusere bivirkninger ved infeksjon på lang sikt sammenlignet med andre legemiddel i denne klassen. Det pågår langtidsstudier for å undersøke bivirkninger, tolerabilitet og effekt av Kesimpta® (ClinicalTrials.gov identifier:NCT03650114).
Doseringskort Kesimpta®
Om en ønsker det, kan en benytte doseringskort til hjelp for å huske dato for når en satte forrige dose. I de vedlagte PDFen er i 2 ulike versjoner: En vanlig PDF som kan printes og fylles ut med penn her, og en der en kan skrive rett inn i PDFen og lagre lokalt på egen PC her. Om en ønsker å få bestilt doseringskort i trykt versjon, vennligst ta kontakt med medisinsk avdeling i Novartis Norge, e-post: [email protected]
Hensikten med å benytte et doseringskort er å forsikre seg om at en får dosering i henhold til pakningsvedlegget i SPCen.
Ofatumumab, virkestoffet til Kesimpta, er et rekombinant, fullstendig humant anti-CD20 monoklonalt immunoglobulin G1 (IgG1)-antistoff. Ofatumumab er designet for å binde seg selektivt målrettet på et spesifikt protein, CD20-molekylet på overfalten av B -lymfocytter. Dette resulterer i B-celledeplesjon og redusert B- og T-celleinteraksjoner, noe som kan redusere betennelsen i sentralnervesystemet.1
CD20-molekylet er et transmembranfosfoprotein, ikke-glykosylert fosfoprotein som uttrykkes i betydelig grad på celleoverflaten på over 95% av B-cellerlymfocytter under nesten alle stadier av B-cellers livssyklus; fra forstadier til B-celler til modne B-lymfocytter, med unntak av pro-B-celler og terminalt differensierte plasmablaster og plasmaceller (se figur 1).5,6 Under celledifferensieringen til plasmablastene, begynner B-celler å nedregulere uttrykket av CD20. CD20 er nedregulert på tidspunktet for differensiering til plasmaceller, og uttrykkes derfor i mindre grad på modne plasmaceller. Dermed er noen plasmablast og de fleste plasmaceller motstandsdyktige mot anti-CD20 B-celledeplesjon. Derimot beholder hukommelse-B-celler CD20, og binding av antistoffer til CD20 vil derfor føre til celledød og deplesjon av disse ved anti-CD20-behandling.6 CD20-molekylet er også uttrykt på en liten andel av sirkulerende T-celler. Antall T-celler som uttrykker CD20, blir derfor også redusert av ofatumumab (SPC pkt. 5.1). Det er også vist at ofatumumab induserer cellelysering både av celler som uttrykker mye CD20, og celler som uttrykker lite CD20. Studier viser en rask og vedvarende B-celledeplesjon etter 1-2 uker.1 Den eksakte fysiologiske funksjonen til CD20 er fortsatt ikke fullt forstått.5
Se film om virkningsmekanismen til Kesimpta® her:
Subkutan administrering av ofatumumab og påfølgende frigjøring/absorpsjon fra vevet gir gradvis interaksjon med B-celler.1 Ofatumumab binder seg til et distinkt epitop som omfatter både de små og store ekstracellulære løkkene i CD20-molekylet.4 Dette fører til en langsom «off-rate» og høy bindingsaffinitet.7,3 Bindingen av ofatumumab til CD20-molekylet induserer lysering av CD20+ B-celler primært via komplement-avhengig cytotoksisitet (CDC) og i mindre grad via antistoff-avhengig cellemediert cytotoksisitet (ADCC).1,7
Aktivering av CDC fører til dannelse av porer i B-cellemembranen, som fører til at den sprekker opp og dør. Ved ADCC, gjenkjenner immunceller (naturlige dreper-celler), B-celler med ofatumumab-binding på B-celler, og frigjør stoffers om induserer celledeød.9
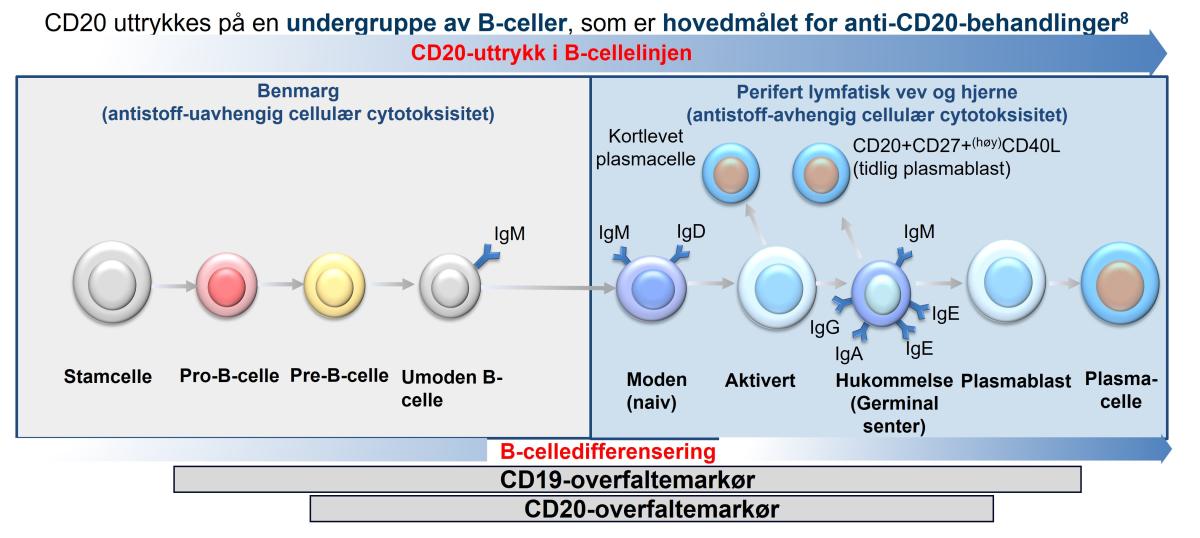
Figur 1: Modning av B-cellene involverer to faser av differensiering: En antigen-avhengig prosess i benmargen, og en antigen-uavhengig prosess som foregår i lymfevevet og i hjernen. Spesifikke kluster av differensiering markører er CD20, CD19 og andre overfaltemarkører som CD22, CD27, CD38, CD138 (ikke vist på illustrasjonen) som er nyttige for å skille overgangsfaser som B-celler passerer gjennom under modning.10 Ofatumumab binder seg til CD20-molekylet. Dette resulterer i B-celledeplesjon og redusert B- og T-celleinteraksjoner, noe som kan redusere betennelsen i sentralnenervesystemet.1,7 Figur tilpasset av Novartis etter Dalakas et al.10 og Greenfield et al.11
B-celledeplesjon
I de kliniske studiene der pasienter med relapserende MS (RMS) ble behandlet med 20mg ofatumumab hver 4. uke, etter et innledende doseregime med 20mg på dag 1, 7, og 14, førte administrering til en rask og vedvarende reduksjon av B-celler til under LLN (definert som 40 celler/µl), så tidlig som to uker etter igangsatt behandling (Figur 2).11
I ASCLEPIOS I/II hadde pasientene ved uke 2 hadde >95 % av pasientene B-cellekonsentrasjoner under LLN, med 82 % av pasientene som nådde B-deplesjon på ≤10 celler/µL innen uke 2, 92 % nådde dette nivået innen uke 4, og 98 % innen uke 12. Dette økte til 98 % av pasientene ved uke 12 og ble opprettholdt i 120 uker (dvs. hele studiebehandlingen).1
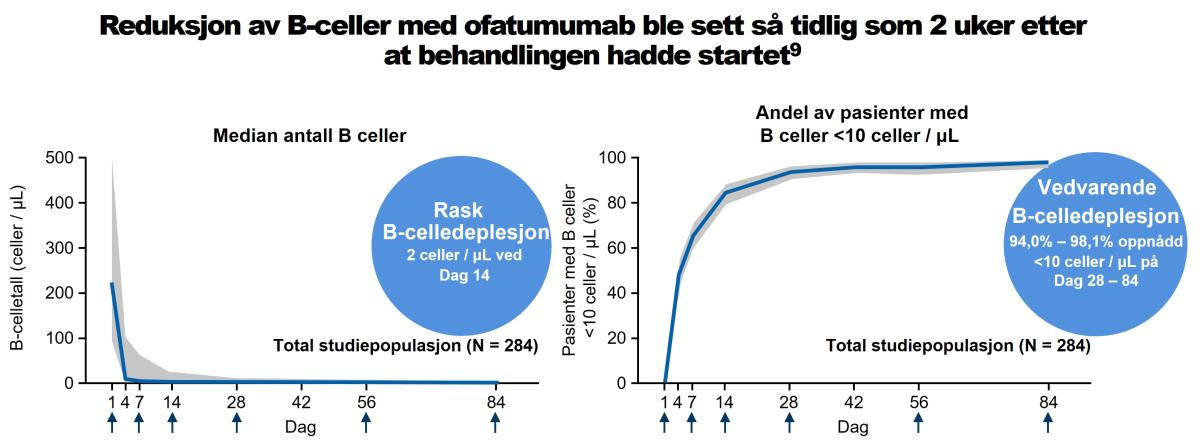
Figur 2: Ofatumumab (20 mg) induserte rask, nesten komplett B-celledeplesjon, uten tegn på rekonstituering mellom de månedlige dosene i fase 2-studien APLIOS.12 Reduksjon av B-celler med ofatumumab ble sett så tidlig som 2 uker etter at behandlingen hadde startet. Figur utarbeidet av Novartis etter Bar-Or A et al.11 Piler, doseadministrasjon; grå skyggelegging, 5.–95. persentilområde for observasjoner (venstre graf) og 95 % konfidensintervall beregnet ved bruk av Clopper-Pearson-metoden på hvert tidspunkt merket på X-aksen (høyre graf).
Gjennoppretting av B-celler
Data fra kliniske fase III-studier ved RMS indikerer at median tid til gjenopprettet B-celletall inntil nedre referanseverid (LLN) eller baselineverdi, var 24,6 uker fra avsluttet behandling. PK-B-cellemodellering og simulering av gjenoppretting av B-celler bekrefter disse dataene og antyder en median tid til gjenopprettet B-celletall inntil LLN, på 23 uker fra avsluttet behandling (se figur 3)1,13
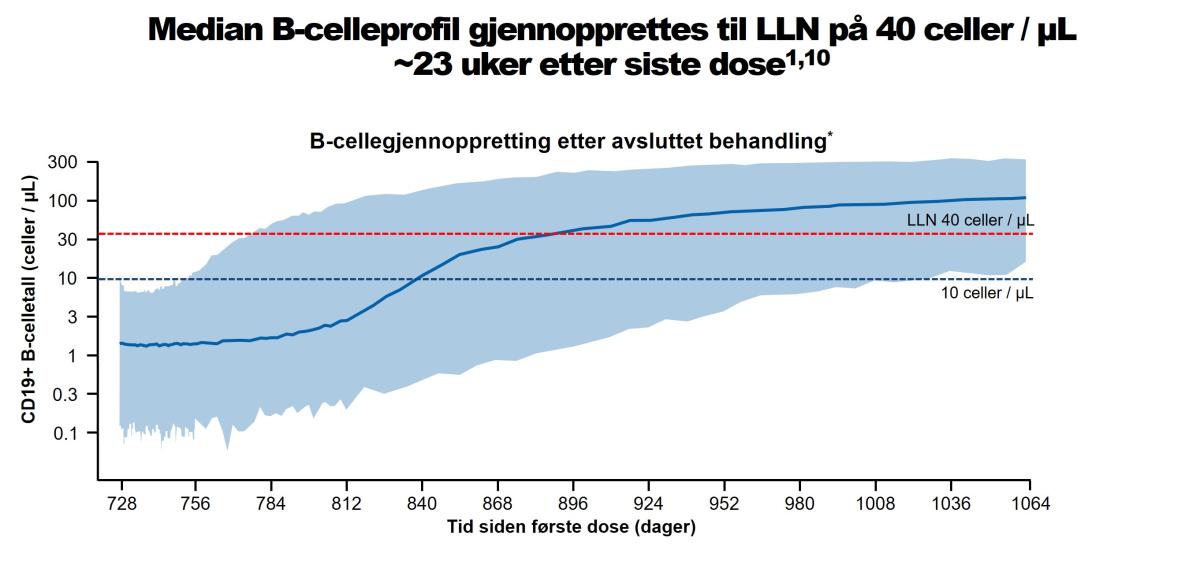
Figur 3: B-cellegjennoppretting etter avsluttet behandling*. PK-B-cellemodellering og simulering av gjenoppretting av B-celler viser en median tid til gjenopprettet B-celletall inntil nedre referansenivå (LLN) på 40 celler/µL på mindre enn 6 måneder (ca. 23 uker) etter siste dose. *17158 B-celletall ble analysert fra 1486 pasienter inkludert i studiene OMS115102, MIRROR, APLIOS og ASCLEPIOS I og II. B-celletall simulert under 0 celler / µL ble sensurert ved 0. Simulert median og 90 % prediksjonsintervall. Simulering er for subkutan rute med ferdifyllt sprøyte og ved bruk av fase III doseringsregime. Figur utarbeidet av Novartis etter Yu et al. 2022.13
Monoklonale antistoffer (mAbs) har veldig spesifikk binding til målepitoper eller antigener (Figur 4).14 Den målrettede bindingen av mAbs betyr at de formidler sin effekt på svært spesifikke måter. Humanisert mAbs can være svært effektive og kan ha reduserte effekter utenfor målet og ha reduserte legemiddel interaksjoner.15 Antistoffbehandling er assosiert med å kunne generere anti-medisin antistoffer (ADAs) ved gjentatt eksponering.14 Fullhumant antistoff har vanligvis redusert immunogent potensial, når sammenlignet med murine, kimære eller humaniserte antistoffer.14,16 Ofatumumab er et fullhumant monoklonalt antistoff, og har ingen murin sekvens (Figur 5).14
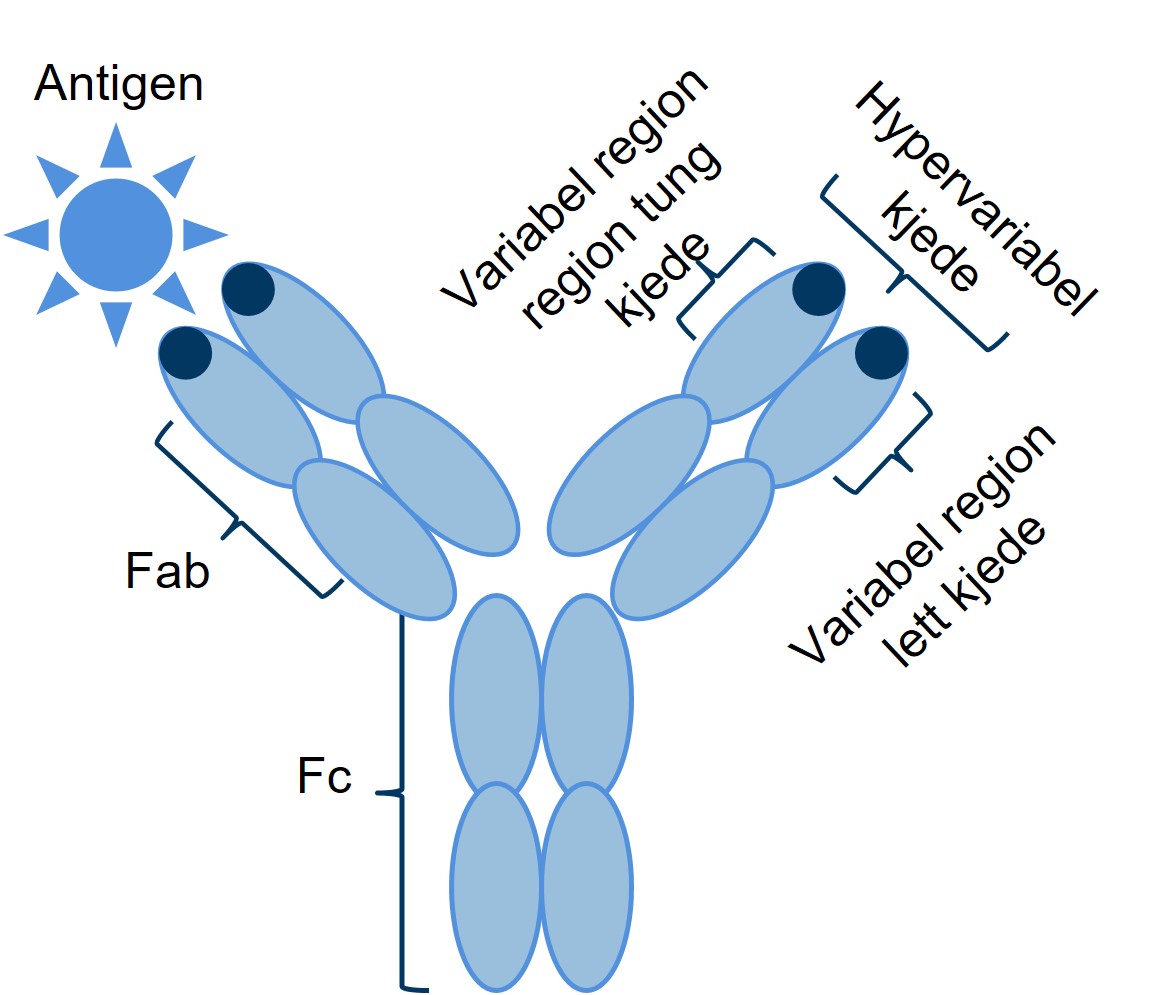
Figur 4: Strukturen til monoklonale antistoffer. Figur utarbeidet av Novartis basert pa Voge NV et al. 2019.14
ADA, anti-drug-antibodies [anti-medisin antistoff]; Fab, fragment antigen-binding region [fraksjon-antigen-binding]; Fc, ragment crystallizable [fragmentet som er krystalliserbart], mAb, monoclonal antibody [monoklonalt antisfoff]
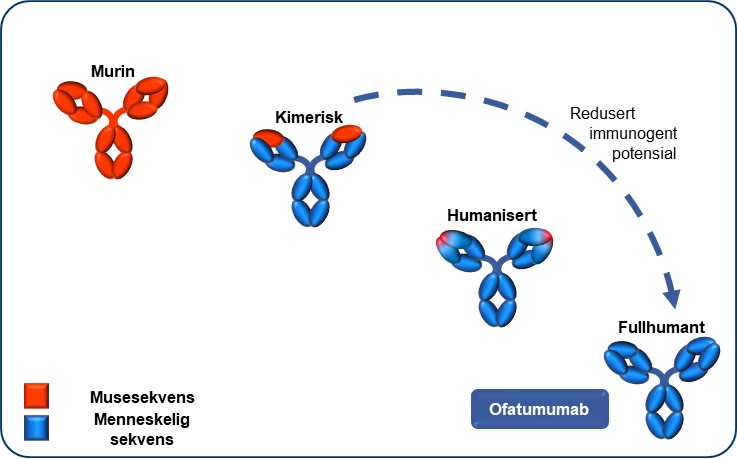
Figur 5: Ofatumumab er et fullstendig humant monoklonalt antistoff, og er det første målrettede anti-B-cellebehandlingen, godkjent for multippel sklerose.1,17,18,19 Figur utarbeidet av Novartis etter Ruuls et al. 2008.18
-
Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
-
Helse Bergen - Haukeland Universitetssykehus. Nyhetsbrev nr. 4, 2023 – indikasjoner for bruk av ofatumumab. Oppdatert: 07.12.2023 . Tilgjengelig fra: https://www.helse-bergen.no/nasjonal-kompetansetjeneste-for-multippel-sklerose-ms/nyhetsbrev-nr.4-2023
-
European Medicines Agency. European public assessment report (EPAR) [Internett]. (oppdatert: 28.01.2021; hentet 10.05.2021). Tilgjengelig fra: https://www.ema.europa.eu/en/medicines/human/EPAR/kesimpta
-
Nye metoder. Beslutningsforum: MS-medisinen Kesimpta innføres [Internett]. (oppdatert: 20.02.2023; hentet 20.02.2023). Tilgjengelig fra: https://nyemetoder.no/Documents/Beslutninger/Beslutningsforum%2020022023_Protokoll.pdf
-
Klein C, Lammens A, Schäfer W, Georges G, Schwaiger M, Mössner E, Hopfner KP, Umaña P, Niederfellner G. Epitope interactions of monoclonal antibodies targeting CD20 and their relationship to functional properties. MAbs. 2013 Jan-Feb;5(1):22-33. doi: 10.4161/mabs.22771.
-
Pavlasova G, Mraz M. The regulation and function of CD20: an "enigma" of B-cell biology and targeted therapy. Haematologica. 2020 Jun;105(6):1494-1506. doi: 10.3324/haematol.2019.
-
Hauser SL, et al. The Development of Ofatumumab, a Fully Human Anti-CD20 Monoclonal Antibody for Practical Use in Relapsing Multiple Sclerosis Treatment. Neurol Ther. 2023 Oct;12(5):1491-1515. doi: 10.1007/s40120-023-00518-0.
-
Lin TS. Ofatumumab: a novel monoclonal anti-CD20 antibody. Pharmgenomics Pers Med. 2010;3:51-9. doi: 10.2147/pgpm.s6840.
-
Golay J, Taylor RP. The Role of Complement in the Mechanism of Action of Therapeutic Anti-Cancer mAbs. Antibodies (Basel). 2020 Oct 28;9(4):58. doi: 10.3390/antib9040058.
-
Dalakas MC. B cells as therapeutic targets in autoimmune neurological disorders. Nat Clin Pract Neurol. 2008 Oct;4(10):557-67. doi: 10.1038/ncpneuro0901.
-
Greenfield AL, Hauser SL. B-cell Therapy for Multiple Sclerosis: Entering an era. Ann Neurol. 2018 Jan;83(1):13-26. doi: 10.1002/ana.25119.
-
Bar-Or A, Wiendl H, Montalban Xet al. Rapid and sustained B-cell depletion with subcutaneous ofatumumab in relapsing multiple sclerosis: APLIOS, a randomized phase-2 study. Mult Scler. 2022 May;28(6):910-924. doi: 10.1177/13524585211044479.
-
Yu H, Graham G, David OJ, et al. Population Pharmacokinetic-B Cell Modeling for Ofatumumab in Patients with Relapsing Multiple Sclerosis. CNS Drugs. 2022 Mar;36(3):283-300. doi: 10.1007/s40263-021-00895-w.
-
Voge NV, Alvarez E. Monoclonal Antibodies in Multiple Sclerosis: Present and Future. Biomedicines. 2019 Mar 14;7(1):20. doi: 10.3390/biomedicines7010020.
-
Castelli MS, McGonigle P, Hornby PJ. The pharmacology and therapeutic applications of monoclonal antibodies. Pharmacol Res Perspect. 2019 Dec;7(6):e00535. doi: 10.1002/prp2.535.
-
Gao SH, Huang K, Tu H, Adler AS. Monoclonal antibody humanness score and its applications. BMC Biotechnol. 2013 Jul 5;13:55. doi: 10.1186/1472-6750-13-55.
-
European Medicines Agency. European public assessment report (EPAR) [Internett]. (oppdatert: 28.01.2021; hentet 10.05.2021). Tilgjengelig fra: https://www.ema.europa.eu/en/medicines/human/EPAR/kesimpta
-
Ruuls SR, Lammerts van Bueren JJ, van de Winkel JG, Parren PW. Novel human antibody therapeutics: the age of the Umabs. Biotechnol J. 2008 Oct;3(9-10):1157-71. doi: 10.1002/biot.200800110. PMID: 18702090; PMCID: PMC2959493.
-
Novartis. Novartis receives EU approval for Kesimpta® (ofatumumab), the first and only self-administered, targeted B-cell therapy for adult patients with relapsing multiple sclerosis [Internett] (oppdatert 30.mars 2021; hentet 4.april 2024). Tilgjengelig fra: https://www.novartis.com/news/media-releases/novartis-receives-eu-approval-kesimpta-ofatumumab-first-and-only-self-administered-targeted-b-cell-therapy-adult-patients-relapsing-multiple-sclerosis

