Femårs sikkerhets- og effektdata publisert på personer med relapserende MS1
Fase 3-studiene ASCLEPIOS I og II viste at ofatumumab var overlegen teriflunomid når det gjelder å redusere årlig attakkrate, MR-lesjoner, og forsinke sykdomspogresjon hos personer med replaserende multippel sklerose (RMS), samtidig som sikkerhetsprofilen var håndterbar i opptil 2,5 år.1 Den påfølgende ublindete forlengelsesstudien ALITHIOS (ClinicalTrials.gov: NCT03650114) har som mål å vurdere langtidssikkerhet og effekt av ofatumumab. 2 og 4-årsresultater er tidligere publisert.3 De publiserte ALITHIOS-studieoppdateringene etter 5 år bygger videre på disse tidligere publiserte dataene og gir samtidig en grundig vurdering av langtids pasientutfall relatert til sykdomsprogresjon og sikkerhet.2
|
Immunfunksjon og immunglobuliner:
|
|
Sikkerhet og tolerabilitet:
|
|
Effekt av ofatumumab på sykdomsaktivitet ved komposittendepunktet NEDA-3 (ingen kliniske attakker, ingen nye eller forstørrede MR-lesjoner, ingen bekreftet funksjonsforverring):
|
Bruk av Kesimpta i Norge:
Kesimpta® (ofatumumab) er et fullstendig humant monoklonalt anti-CD20-antistoff med et 20 mg månedlig subkutant doseringsregime av pasienten selv hjemme som har vist rask og vedvarende deplesjon av B-cellene (SPC avsnitt 5.1).1,4 Ofatumumab er indisert til behandling av voksne pasienter med relapserende former for multippel sklerose (RMS) med aktiv sykdom definert ved kliniske eller bildediagnostiske funn.4 Godkjent av Beslutningsforum (ID2020_066:): Til behandling av voksne med relapserende former for multippel sklerose (RMS) med aktiv sykdom definert ved kliniske eller bildediagnostiske funn når annet, rimeligere anti-CD20 antistoff er vurdert uegnet. Dette betyr at det alltid må gjøres en vurdering om egnethet før Kesimpta kan brukes, men det er ikke et krav at annen rimeligere anti-CD20 antistoff må ha vært prøvd først. MS-kompetansenettverket og spesialistgruppen for MS har gitt medisinske anbefalinger for bruk av ofatumumab på subindikasjoner i nyhetsbrev nr 4.5
Studiebakgrunn og sammendrag:2
Metode:
ALITHIOS består av to populasjoner for studieanalyser: En sikkerhetsanalyse (N = 1969; deltakere som mottok ≥ 1 dose ofatumumab i ASCLEPIOS I/II, APLIOS, APOLITOS eller ALITHIOS) og en populasjon for effektanalyse (N = 1882; deltakere randomisert til ofatumumab [OMB-OMB] eller teriflunomid [TER-OMB] i ASCLEPIOS I/II, uavhengig av om de deltok i ALITHIOS). Datakutt var 25. september 2022.
Forfatterne fremhever at ALITHIOS er en ublindet forlengelsesstudie. Den mangler en sammenligningsgruppe, og dataene er begrenset av populasjonen som ble selektert i henhold til fase 3 ASCLEPIOS I & II inklusjon og eksklusjonskriteriene, noe som kan gjøre at den ikke reflekterer en komplett RMS populasjon i klinisk praksis. For eksempel er det begrensede data på deltakere over 55 år da inklusjonskriteriene var deltalkere under 55 år i fase 3-studiene.
Sikkerhetsanalyse
Av 1969 pasienter i sikkerhetsanalysen, fullførte 1703 (86,5 %) hovedstudiene og gikk videre til ALITHIOS.
Effektanalyse
Totalt 1882 pasienter ble randomisert til behandling i ASCLEPIOS I/II (OMB: 946; TER: 936). Av disse gikk 1367 (72,6 %) videre til ALITHIOS-studien (OMB-OMB: n = 690; TER-OMB: n = 677). Ved datakutt mottok 1145 av 1367 (83,8 %) fortsatt behandling med ofatumumab. Demografiske og sykdomsrelaterte karakteristika var generelt godt balansert mellom gruppene ved oppstart av hovedstudiene. I ALITHIOS var de vanligste årsakene til studieavbrudd pasient-/foresattbeslutning (6,6 %) og bivirkninger (4,5 %).
Demografi og kliniske karakteristika
Pasientene i ALITHIOS-studien hadde en gjennomsnittsalder på 38 år, med balansert kjønnsfordeling der omtrent 68 % var kvinner. Gjennomsnittlig BMI var 25,6 kg/m². Tid siden symptomdebut var rundt 8 år, og tid siden MS-diagnose var cirka 5,9 år. Gjennomsnittlig EDSS-score ved oppstart var 2,9, og immunoglobulinnivåene lå innenfor normalområdet (IgG: 10,3 g/L; IgM: 1,34 g/L).
Sikkerhetsprofilen til ofatumumab var i samsvar med tidligere funn og ble opprettholdt i opptil 5 år hos personer med RMS, uten at det ble identifisert nye sikkerhetssignal.
- De vanligste bivirkningene var infeksjoner: COVID-19 (30,3 %), nasofaryngitt (19 %), øvre luftveisinfeksjoner (12,8 %) og urinveisinfeksjoner (12,7 %). De fleste infeksjonene (90,3 %) gikk over uten at behandlingen med ofatumumab måtte avbrytes. Andelen deltakere som seponerte ofatumumab på grunn av bivirkninger var 7,1 %. Alvorlige bivirkninger (SAEs) forekom hos 289 av 1969 pasienter (14,7 %), med en eksponeringsjustert insidensrate (EAIR) på 4,68 SAEs per 100 pasientår (95 % KI: 4,17–5,26).
- Eksponeringsjustert insidensrate (EAIR) for alvorlige infeksjoner var 1,63 per 100 pasient-år (95 % KI: 1,35–1,97), noe som er i samsvar med raten i ASCLEPIOS I/II-studiene (EAIR: 1,55). De vanligste alvorlige infeksjonene var COVID-19-pneumoni (1,37 %), COVID-19 (1,37 %) og blindtarmbetennelse (0,7 %). De fleste alvorlige infeksjonene (56,6 %) var grad 3 i alvorlighetsgrad, mens 34,0 % var grad 1/2 og 9,4 % var grad 4. De fleste (92,6 %) gikk over uten at behandlingen med ofatumumab måtte avbrytes. Blant pasientene som fullførte 5 års behandling med ofatumumab, var EAIR for alvorlige infeksjoner 1,28 per 100 pasient-år (95 % KI: 0,87–1,89).
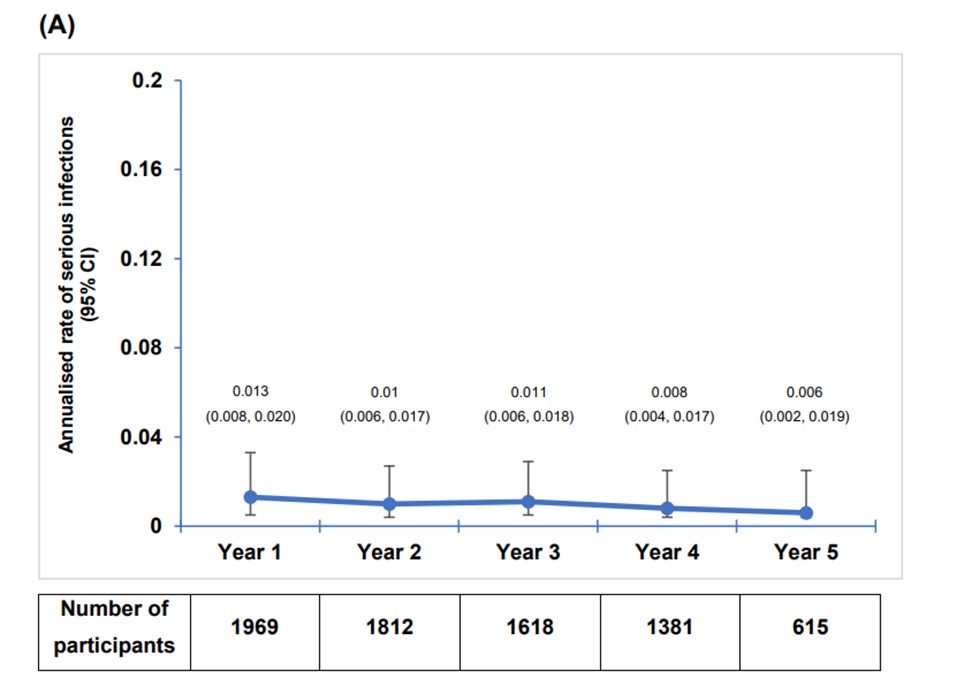
Figur S2A. Årlig rate av alvorlige infeksjoner. Årlig rate av alvorlige infeksjoner (ekskludert COVID-19) var stabil over fem år med ofatumumab-behandling. Gjengitt fra Hauser S. et al. (2025), Long-Term Safety and Efficacy of Ofatumumab in Patients with Relapsing Multiple Sclerosis: Final Analysis from the ALITHIOS Open-Label Extension Study. Neurol Ther. 2025;14(3):789–812. Neurology and Therapy. Supplementary Material [Figur S2A]; lisensiert under CC BY 4.0. Tilgjengelig fra: https://doi.org/10.1007/s40120-025-00784-0
- Den totale forekomsten av maligniteter var 1,06 % (n = 21), med en forekomstjustert rate (EAIR) på 0,32 per 100 pasient-år (95 % konfidensintervall: 0,21–0,48). Det ble ikke observert noen økning i EAIR for maligniteter over tid (år 1: 0,47 [95 % KI: 0,25–0,91]; år 5: 0,37 [95 % KI: 0,09–1,50]). Forekomsten av maligniteter blant pasientene som gjennomførte hele 5-årsperioden var svært lav, med kun ett tilfelle registrert – tilsvarende en justert rate på 0,05 per 100 pasient-år.
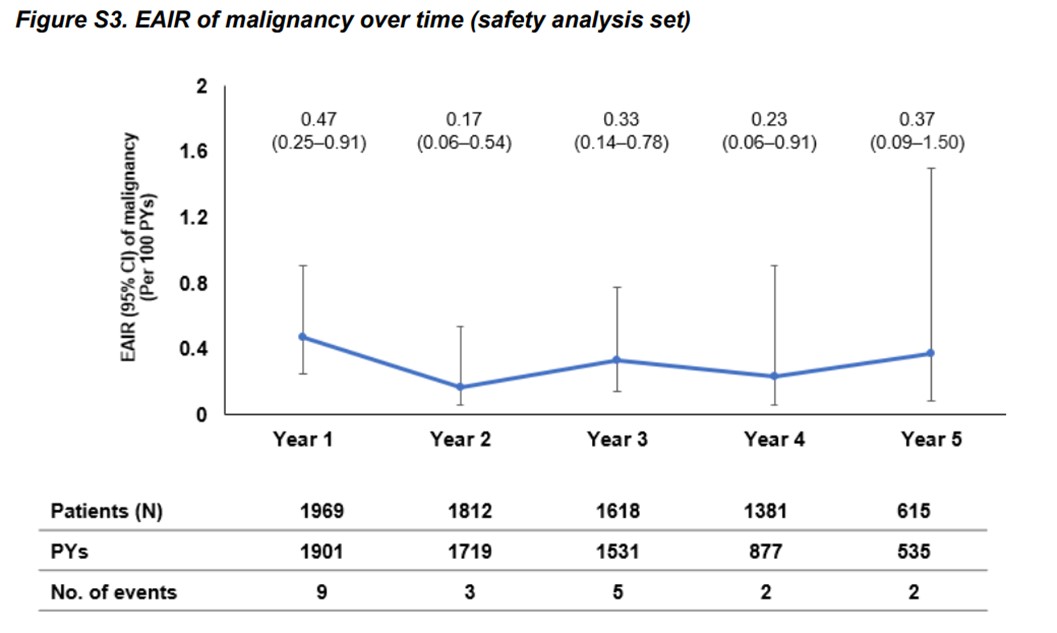
Figur S3. Maligniteter (kreft). Årlig rate av alvorlige infeksjoner (ekskludert COVID-19) var stabil over fem år med ofatumumab-behandling. Gjengitt fra Hauser S. et al. (2025), Long-Term Safety and Efficacy of Ofatumumab in Patients with Relapsing Multiple Sclerosis: Final Analysis from the ALITHIOS Open-Label Extension Study. Neurol Ther. 2025;14(3):789–812. Neurology and Therapy. Supplementary Material [Figur S3]; lisensiert under CC BY 4.0. Tilgjengelig fra: https://doi.org/10.1007/s40120-025-00784-0
- Gjennomsnittlige nivåer av immunglobulin G (IgG) i serum forble stabile fra første dose med ofatumumab og gjennom hele 5-årsperioden (se Figur S4A). IgG-nivåene lå over nedre normalgrense (LLN, 5,65 g/L) hos 98 % av pasientene ved alle måletidspunkter, og andelen pasienter med IgG under LLN forble stabil i løpet av behandlingsperioden (se Figur S4B). Gjennomsnittlige IgM-nivåer falt i starten, men stabiliserte seg og forble over LLN (0,40 g/L) fra første dose og gjennom 5 år. Hos 69,4 % av pasientene lå IgM-nivåene over LLN ved alle målinger. Andelen pasienter med IgM-nivåer under nedre normalgrense (LLN) økte fra 10,6 % etter ett års behandling til 24,1 % etter opptil fem år med ofatumumab. I løpet av femårsperioden avbrøt 0,2 % av pasientene behandlingen på grunn av lave IgG-nivåer, og 10,3 % på grunn av lave IgM-nivåer. Når man ser på hele studiepopulasjonen, var det henholdsvis 0,2 % og 3,6 % som permanent avsluttet behandlingen av samme årsaker. Sensitivitetsanalyser viste at de gjennomsnittlige nivåene av IgG og IgM over tid ikke endret seg vesentlig, selv etter at man tok høyde for pasienter som avbrøt behandlingen på grunn av lave nivåer.
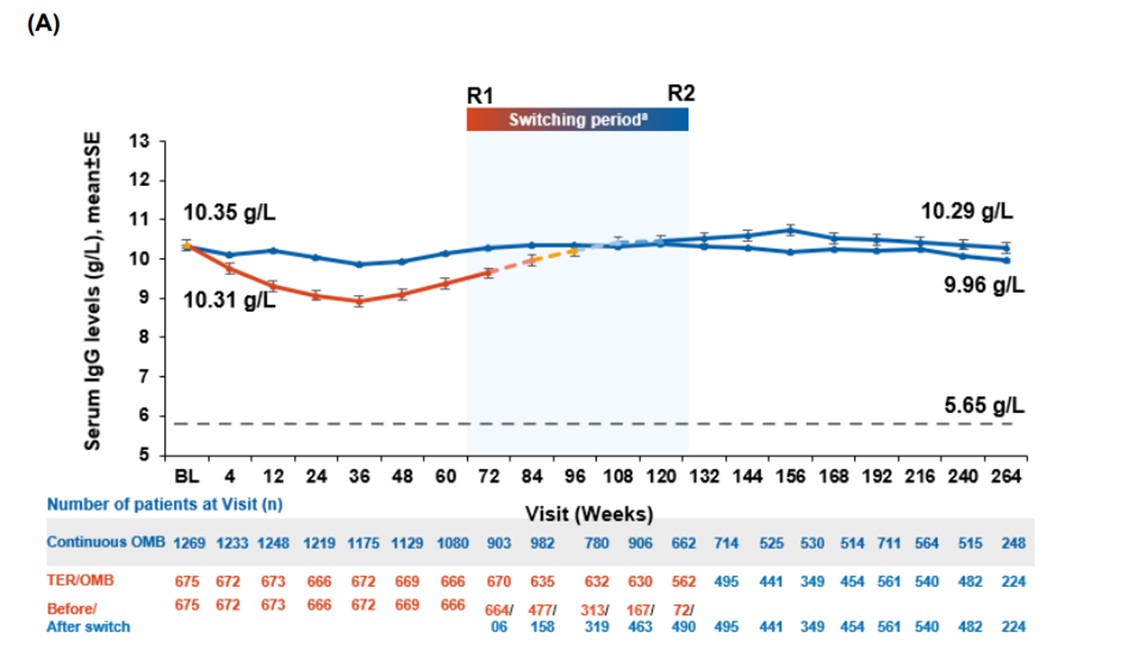
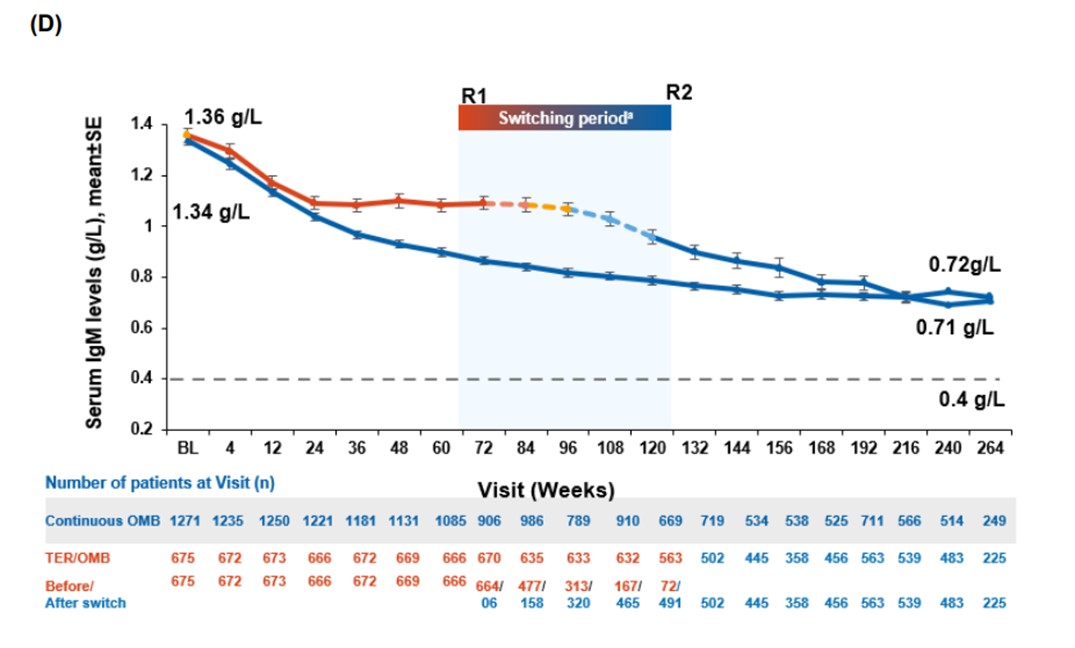
Figur S4A Gjennomsnittlig serum immunglobulin-nivå (IgG) og IgM-nivå (Figur S4D). Gjengitt fra Hauser S. et al. (2025), Long-Term Safety and Efficacy of Ofatumumab in Patients with Relapsing Multiple Sclerosis: Final Analysis from the ALITHIOS Open-Label Extension Study. Neurol Ther. 2025;14(3):789–812. Neurology and Therapy. Supplementary Material [Figur S3]; lisensiert under CC BY 4.0. Tilgjengelig fra: https://doi.org/10.1007/s40120-025-00784-0
- Gjennomsnittlige nivåer av nøytrofile granulocytter forble stabile og lå over nedre referansegrense (LLN) gjennom opptil 5 års behandling med ofatumumab.
- Resultatene understreker tolerabiliteten til ofatumumab, med lave forekomster av injeksjonsrelaterte reaksjoner (IRR), og langvarig bevaring av imunforsvar, vist ved opprettholdelse av immunglobulin G (IgG)-nivåer og imunrespons etter COVID-19-vaksinasjon og -infeksjon.
Effektresultatene
- Resultatene viste at kontinuerlig behandling med ofatumumab (dvs. tidlig oppstart) i opptil 5 år viste vedvarende effekt på attakrate, betydelig undertrykking av MR-lesjonsaktivitet, høy andel pasienter uten tegn til sykdomsaktivitet (NEDA-3) (se tabell 2 under), og redusert akkumulering av sykdomsprogresjon over tid – inkludert progresjon uavhengig av tilbakefall ([progression independent of relapse activity (PIRA)].
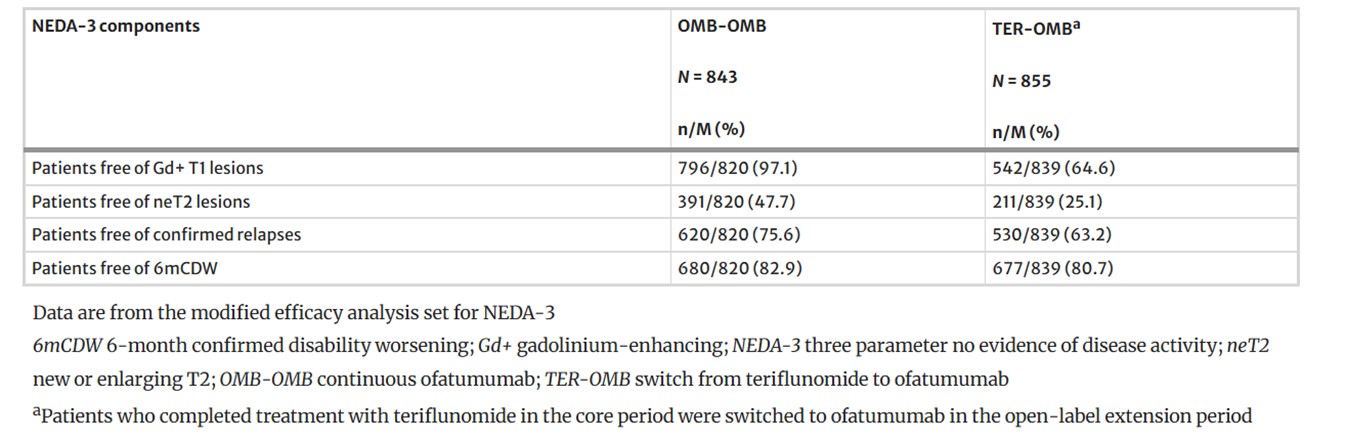
Tabell 2. Andel pasienter uten sykdomsaktivitet i de enkelte NEDA-3-komponentene over 5 år (modifisert effektpopulasjon). Gjengitt fra Hauser S. et al. (2025), Long-Term Safety and Efficacy of Ofatumumab in Patients with Relapsing Multiple Sclerosis: Final Analysis from the ALITHIOS Open-Label Extension Study. Neurol Ther. 2025;14(3):789–812. Neurology and Therapy. Lisensiert under CC BY 4.0. Tilgjengelig fra: https://doi.org/10.1007/s40120-025-00784-0
Etterlevelese (compliance)
- Etterlevelse til ofatumumab-behandling var høy, med gjennomsnitt på 95,97 %, median 98,95 %, og interkvartilområde fra 96,13 % (Q1) til 100 % (Q3), noe som indikerer god behandlingsadhesjon i studiepopulasjonen.
Konklusjon:
Forfatterne konkluderer med at resultatene bekrefter at ofatumumab har god effekt og sikkerhet over en periode på opptil 5 år ved behandling av attakkpreget multippel sklerose (RMS). Behandlingen viser en gunstig balanse mellom nytte og risiko. Funnene støtter tidlig oppstart med ofatumumab for å redusere sykdomsaktivitet og forebygge varig funksjonsnedsettelse.
Les publikasjonen av Hauser et al. (2025) her
For sikkerhetsinfomasjonen, se felleskatalogen
Referanser:
- Hauser SL, et al; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
- Hauser SL, et al. Five-Year Safety and Efficacy Outcomes with Ofatumumab in Patients with Relapsing Multiple Sclerosis. Neurol Ther. 2025 Jul 13. doi: 10.1007/s40120-025-00784-0.
- Hauser SL, et al. Efficacy and safety of four-year ofatumumab treatment in relapsing multiple sclerosis: The ALITHIOS open-label extension. Mult Scler. 2023 Oct;29(11-12):1452-1464. doi: 10.1177/13524585231195346.
- Kesimpta® (ofatumumab) preparatomtale (SC). Tilgjengelig fra: https://www.ema.europa.eu/no/documents/product-information/kesimpta-epar-product-information_no.pdf
- Helse-Bergen. Nyhetsbrev nr. 4, 2023- Indikasjoner for bruk av ofatumumab. Publisert 07.12.2023. Tilgjengelig fra: Nyhetsbrev nr. 4, 2023- Indikasjoner for bruk av ofatumumab - Helse Bergen HF
