Hva er indikasjonen for ▼Kesimpta?
Svar: ▼Kesimpta (ofatumumab) 20mg subkutan injeksjon er godkjent av Europeiske legemiddelbyrået (European Medicines Agency, EMA) for relapserende multippel sklerose (RMS).1
Offentlig finansiering i Norge: Beslutningsforum for nye metoder har godkjent Kesimpta til behandling av voksne pasienter med relapserende former for multippel sklerose (RMS) med aktiv sykdom definert ved kliniske eller bildediagnostiske funn når annet, rimeligere anti-CD20 antistoff er vurdert uegnet.2
Referanse
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
2. Nye metoder. Beslutningsforum: MS-medisinen Kesimpta innføres [Internett]. (oppdatert: 20.02.2023; hentet 20.02.2023). Tilgjengelig fra: https://nyemetoder.no/Documents/Beslutninger/Beslutningsforum%2020022023_Protokoll.pdf
Hva er virkningsmekanismen til ▼Kesimpta (ofatumumab)?
Svar: ▼Kesimpta (ofatumumab) er fullhumant anti-CD20 monoklonalt antistoff konstruert med rekombinante DNA-teknikker (bruk av biter av DNA fra ulike kilder og satt sammen til ett molekyl) og designet for å binde seg selektivt målrettet på CD20-uttrykkende B-celler.1
CD20-molekylet er et transmembranfosfoprotein som uttrykkes på B-lymfocytter fra forstadier til B-celler til modne B-lymfocytter. CD20- molekylet uttrykkes også på en liten fraksjon av aktiverte T-celler. Subkutan administrering av ofatumumab og påfølgende frigjøring/absorpsjon fra vevet gir en gradvis interaksjon med B-celler. 2
Bindingen av ofatumumab til CD20 induserer lysering av CD20+ B-celler primært via komplement-avhengig cytotoksisitet (CDC) og i mindre grad via antistoff-avhengig cellemediert cytotoksisitet (ADCC). Det er også vist at ofatumumab induserer cellelysering både av celler som uttrykker mye CD20, og celler som uttrykker lite CD20. Antall T-celler som uttrykker CD20, blir også redusert av ofatumumab.2
Referanse
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
2. Cotchett KR, Dittel BN, Obeidat AZ. Comparison of the Efficacy and Safety of Anti-CD20 B Cells Depleting Drugs in Multiple Sclerosis. Mult Scler Relat Disord. 2021 Apr;49:102787. doi: 10.1016/j.msard.2021.102787.
Hvordan skiller virkningsmekanismen og administrasjonsveien for ▼Kesimpta (ofatumumab) seg fra andre anti-CD20 monoklonale antistoffbehandlinger?
Svar: Kimeriske antistoffer (rituksimab, ublituksimab) og humaniserte antistoffer (okrelizumab) har en human konstant region og en variabel region som er murin og human. Disse monoklonale antistoffene (rituksimab, okrelizumab, ublituksimab, ofatumumab) er klassifisert som IgG1 monoklonale antistoffer. Kimeriske antistoffer er to tredjedeler humane, mens humaniserte antistoffer er nær 90% humane. Ofatumumab er et fullhumant monoklonalt antistoff (mAb).1 Siden ofatumumab er et fullhumant mAb uten musesekvenser, er det en gunstig lav immunogenisitet som forventes å gi lav sikkerhetsrisiko.2
De fire mAbene binder seg på forskjellige steder på CD20-molekylet. Rituximab, okrelizumab og ublituksimab binder seg til den store ekstracellulære løkken til CD20, mens ofatumumab binder seg til den store og den lille ekstracellulære løkken på CD20 epitopet.1 Til tross for at alle disse mAbene er klassifisert som type 1-antistoffer, så erden relative CDC-aktiviteten forskjellig mellom mAbene.1 Ofatumumab har en langsommere dissosiasjonshastighet fra CD20 enn den kimeriske mAb. Etter at ofatumumab binder seg på celleoverfalten, vil ofatumumab selektivt føre til deplesjon av CD20-uttrykkende celler gjennom antistoffavhengig cellemediert cytotoksisitet (ADCC), komplementavhengig cytotoksisitet (CDC) og apoptose. Den nøyaktige mekanismen hvordan ofatumumab utøver kliniske effekter ved multippel sklerose er likevel ikke kjent, men er sannsynlig mediert av reduksjon av antall og funksjon av CD20-uttrykkende B-celler.1,3,4 Sammenlignet med okrelizumab, forårsaker ofatumumab mer komplementavhengig cytotoksisitet (CDC) enn antistoffavhengig cellemediert cytotoksisitet (ADCC), selv om den kliniske relevansen av disse mekanistiske forskjellene er ukjent.1
IgG monoklonale antistoffer har vanligvis en halveringstid på 21 dager. Den terminale eliminasjonshalveringstiden for rituksimab, okrelizumab og ofatumumab er henholdsvis 22 dager, 26 dager og 16 dager. Raskere utskillelse av ofatumumab vil være fordelaktig for pasienter som må avbryte behandlingen av sikkerhetshensyn. Den kortere halveringstiden vil kreve hyppigere administrering for å opprettholde terapeutiske effekter.1 Ofatumumab har også fordelen av at den kan administreres hjemme av pasienten selv, etter at første dose er satt på sykehus.5
Referanse
1. Cotchett KR, Dittel BN, Obeidat AZ. Comparison of the Efficacy and Safety of Anti-CD20 B Cells Depleting Drugs in Multiple Sclerosis. Mult Scler Relat Disord. 2021 Apr;49:102787. doi: 10.1016/j.msard.2021.102787.
2. Ruuls SR, Lammerts van Bueren JJ, van de Winkel JG, Parren PW. Novel human antibody therapeutics: the age of the Umabs. Biotechnol J. 2008 Oct;3(9-10):1157-71. doi: 10.1002/biot.200800110.
3. Zhang B. Ofatumumab. MAbs. 2009 Jul-Aug;1(4):326-31. doi: 10.4161/mabs.1.4.8895. Epub 2009 Jul 1. PMID: 20068404; PMCID: PMC2726602.
4. Lin TS. Ofatumumab: a novel monoclonal anti-CD20 antibody. Pharmgenomics Pers Med. 2010;3:51-9. doi: 10.2147/pgpm.s6840. Epub 2010 May 10. PMID: 23226042; PMCID: PMC3513208
5. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
Hvordan er farmakokinetikken til ▼Kesimpta (ofatumumab)?
Svar: Halveringstiden ved steady-state ble estimert til omtrent 16 dager etter gjentatt subkutan administrering av ofatumumab i en dose på 20 mg.1 Den biologiske effekten er lenger. Data fra kliniske fase III-studier ved RMS indikerer at etter avsluttet behandling er median tid til gjenopprettet B-celletall inntil nedre referansenivå (LLN) eller baselineverdi, 24,6 uker.1
Referanse
1. Statens legemiddelverk. Kesimpta® (ofatumumab) – preparatomtale (SPC) [Internett]. Oslo: Statens legemiddelverk. Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=0143535b-bfd3-4430-876d-305a6512a2df&searchquery=Kesimpta
Har ▼Kesimpta (ofatumumab) legemiddelinteraksjoner?
Svar: Ingen interaksjonsstudier har blitt utført, da ingen interaksjoner via cytokrom P450-enzymer, andre metaboliserende enzymer eller transportproteiner forventes.1
Referanse
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
Hva er de hyppigst rapporterte bivirkningene ved ▼Kesimpta (ofatumumab)?
Svar: De viktigste og hyppigst rapporterte bivirkningene er infeksjoner i øvre luftveier (39,4 %), systemiske injeksjonsrelaterte reaksjoner (20,6 %), reaksjoner på injeksjonsstedet (10,9 %) og urinveisinfeksjoner (11,9 %).1
Det totale andelen infeksjoner og alvorlige infeksjoner hos pasienter behandlet med ofatumumab var tilsvarende som hos de pasientene behandlet med teriflunomid (henholdvis 51,6% vs. 52,7% og 2,5% vs. 1,8%).1,2
Tabell 1. Bivirkningstabell – SmPC1
Bivirkninger som har vært rapportert i forbindelse med bruk av ofatumumab i pivotale kliniske studier ved RMS, er oppgitt i tabell 1 i henhold til MedDRAs organklassesystem. Innen hver organklasse er bivirkninger rangert etter frekvens, med de hyppigst forekommende reaksjonene først. Innen hver frekvensgruppering er bivirkninger presentert etter synkende alvorlighetsgrad. I tillegg er de tilsvarende frekvenskategoriene for hver bivirkning basert på følgende inndeling: svært vanlige (≥ 1/10), vanlige (≥ 1/100 til < 1/10), mindre vanlige (≥ 1/1000 til < 1/100), sjeldne (≥ 1/10 000 til < 1/1000), svært sjeldne (< 1/10 000), ikke kjent (kan ikke anslås ut ifra tilgjengelige data).

Referanse
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
2. Hauser SL, et al; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
Hvilken andel av pasientene i hver behandlingsarm fullførte de pivotale fase 3-studiene?
Svar: I ASCLEPIOS I ble studien fullført av 89,5% av pasientene i ofatumumab-gruppen og av 81,4% av pasientene i teriflunomidgruppen. I ASCLEPIOS II var de tilsvarende prosentene 82,5% og 82,1%.1
Denne forskjellen ble drevet av andelen pasienter som avbrøt behandlingen på grunn av en pasient eller vergebeslutning (3,4% versus 9,1% for henholdsvis ofatumumab versus teriflunomid) og manglende effekt (0,2% for ofatumumab versus 2,6% for teriflunomid).2
Referanse
1. Hauser SL, et al; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
2. Clinical Review Report: Ofatumumab (Kesimpta): (Novartis Pharmaceuticals Canada Inc.): Indication: Multiple sclerosis, relapsing-remitting [Internet]. Canadian Agency for Drugs and Technologies in Health, 2021. Hentet fra: https://www.ncbi.nlm.nih.gov/books/NBK572489/#:~:text=Patient%20Disposition&text=A%20differential%20dropout%20rate%20(discontinuation,patients%20in%20the%20teriflunomide%20group (hentet 8.august 2023)
Hvilke andel av pasientene i hver behandlingsarm avsluttet studien i de pivotale fase 3-studiene ASCLEPIOS I/II på grunn av bivirkninger?
Svar: Andelen som avbrøt behandlingen på grunn av bivirkninger var tilsvarende mellom behandlingsgruppene (5,7% av ofatumumab-behandlete pasienter, og 5,2% av teriflunomid-behandlete pasienter) (SPC pkt. 5.1).1 Årsaken var i hovedsak på grunn av lave immunoglobulin M-nivå (3,3%) (lave immunglobulin M-nivå som førte til avbrytelse av studien var definert i protokollen som 10% under nedre referanseverdi).2
Referanse
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
2. Kang C, Blair HA. Ofatumumab: A Review in Relapsing Forms of Multiple Sclerosis. Drugs. 2022 Jan;82(1):55-62. doi: 10.1007/s40265-021-01650-7.
Hvordan er sikkerhetssignalene over tid med▼Kesimpta (ofatumumab)?
Svar: I de pivotale fase III-studiene var det nytte/risiko-profilen for ofatumumab gunstig sammenlignet med teriflunomid i en bred populasjon med relapserende MS,1 samt i en predefinert populasjon av nydiagnostiserte og/eller behandlingsnäive pasienter,2 så vel som pasienter som tidligere hadde blitt Tre og halvårsdata,3 samt interimanalyser fra forlengelsesstudien ALITHIOS,3,4 har vist at behandling med ofatumumab opptil fire år er godt tolerert hos pasienter med relapserende MS, uten nye identifiserte sikkerhetssignaler.5
Referanse
3. Hauser SL, et al; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
4. Gärtner J, et al. Efficacy and safety of ofatumumab in recently diagnosed, treatment-naive patients with multiple sclerosis: Results from ASCLEPIOS I and II. Mult Scler. 2022 Sep;28(10):1562-1575. doi: 10.1177/13524585221078825.
5. Hauser SL, et al. Safety experience with continued exposure to ofatumumab in patients with relapsing forms of multiple sclerosis for up to 3.5 years. Mult Scler. 2022 Sep;28(10):1576-1590. doi: 10.1177/13524585221079731.
6. ClinicalTrials.gov [Internet]. ClinicalTrials.gov Identifier: NCT03650114. Long-term Safety, Tolerability and Effectiveness Study of Ofatumumab in Patients With Relapsing MS (ALITHIOS). Tilgjengelig fra: https://clinicaltrials.gov/ct2/show/NCT03650114
7. Hauser SL, et al. The Development of Ofatumumab, a Fully Human Anti-CD20 Monoclonal Antibody for Practical Use in Relapsing Multiple Sclerosis Treatment. Neurol Ther. 2023 Jul 14. doi: 10.1007/s40120-023-00518-0.
Immunogenitet
Ofatumumab er et fullt humant mAb uten musesekvenser, med gunstig lav immunogenitet som derfor forventes å gi lav klinisk sikkerhetsrisiko.1,2
Immunogeniteten til ofatumumab ble vurdert i ASCLEPIOS I og II. I fase III-studiene ved RMS var den totale insidensen av behandlingsinduserte antistoffer mot legemidlet (ADA) på 0,2 % (2 av 914) hos pasienter behandlet med ofatumumab, og det ble ikke observert behandlingsforsterkende eller nøytraliserende ADA hos noen pasienter.2 I ASCLEPIOS-studiene ble gjennomsnittlig IgM-nivå redusert med 30,9 % etter 48 uker på studien, og med 38,8 % etter 96 uker. IgM-nivået var under 0,34 g/dL hos 14,3 % av pasientene. De reduserte IgM-nivåene var ikke assosiert med økt risiko for infeksjon eller alvorlig infeksjon. Motsatt økte immunoglobulin G (IgG) nivåer med 4,3 % etter 48 uker, og med 2,2 % etter 96 uker.2
Innvirkningen av positive ADA-titre på farmakokinetikken, sikkerhetsprofilen eller B-celle-kinetikken kan ikke vurderes grunnet den lave forekomsten av ADA forbundet med ofatumumab.2
Referanse
1. Ruuls SR, Lammerts van Bueren JJ, van de Winkel JG, Parren PW. Novel human antibody therapeutics: the age of the Umabs. Biotechnol J. 2008 Oct;3(9-10):1157-71. doi: 10.1002/biot.200800110.
2. Kang C, Blair HA. Ofatumumab: A Review in Relapsing Forms of Multiple Sclerosis. Drugs. 2022 Jan;82(1):55-62. doi: 10.1007/s40265-021-01650-7.
3. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
Hvilke effekter av ▼Kesimpta (ofatumumab) på multippel sklerose er vist i de kliniske studiene?
Svar: I de samlede analysene (ASCLEPIOS I & II) var nøkkelendepunkter:1
|
|
Ofatumumab (n=923) |
Teriflunomide (n=921) |
Risikoreduksjon |
|
Årlig attakkrate (ARR) (primære endepunktet, samlet analyse) |
0.11 (0.09-0.13) |
0.24 (0.21-0.27) |
53.9% (<0.001) |
|
Antall av nye gadolinium-forsterkende lesjoner på T1-vekted MR gjennomsnitt (samlet analyse) |
0.02 per scan (0.01-0.03) |
0.50 per scan (0.42 to 0.59) |
95.9% (<0.001) |
|
Andel pasienter med bekreftet sykdomsprogresjon ved 3 måneder (samlet analyse) |
10.9% |
15.0% |
34.4% (0.003) |
|
Andel pasienter med bekreftet sykdomsprogresjon ved 6 måneder (samlet analyse) |
8.1% |
12.0% |
32.4% (p=0,012) |
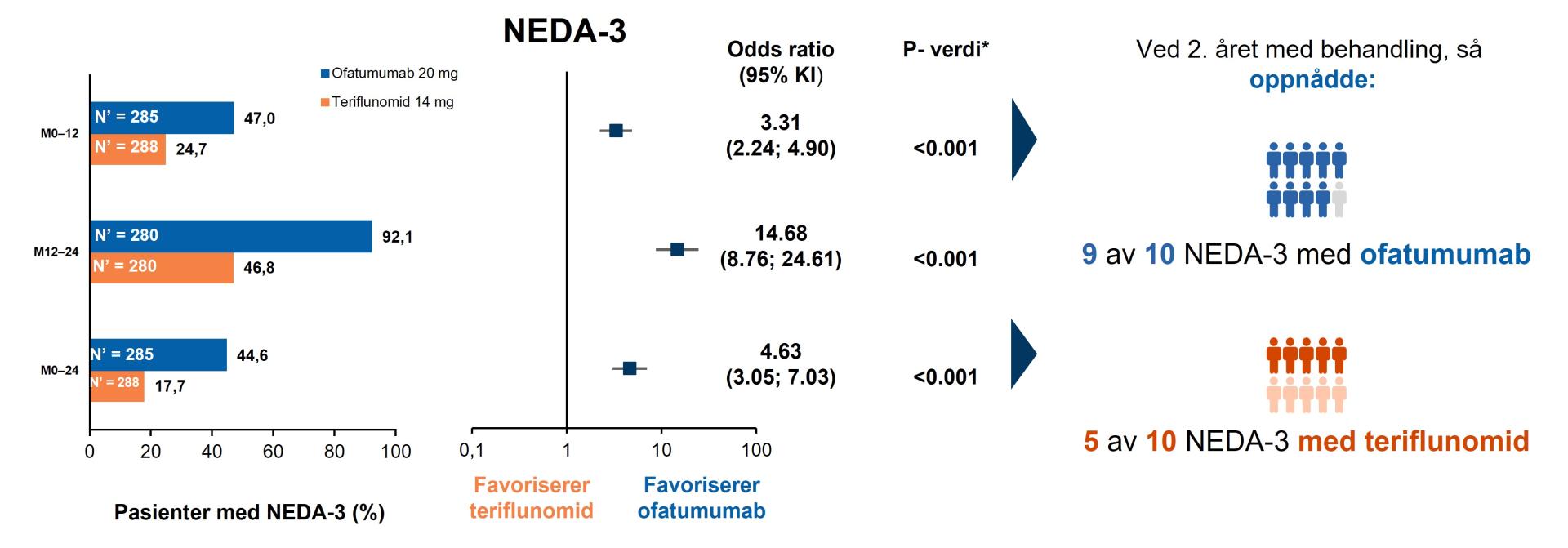
Figur 1: Ofatumumab økte sjansene at ny-diagnostiserte, behandlingsnaïve pasienter å oppnå NEDA-3, både i første og andre året med behandling. NEDA-3 kriterier: bekreftet attakker, ingen 6mnd bekreftet sykdomsforverring og ingen MR aktivitet (dvs Gd forsterkende T1-lesjoner eller forstørrede T2 lesijoner på MR- scann vsersus baseline). Figur utarbeidet av Novartis basert på Gärtner J, et al.2
*Indikerer statistisk signifikans (tosidig) på 0,05 nivå; †re-baselining for år 2 (måned 12–24) ble utført ved måned 12 for å justere for virkningen av sykdomsaktivitet som skjedde før behandlingsstart (T2-lesjoner) og fortsetter gjennom det første behandlingsåret. Denne omleggingen tillater nøyaktig måling av virkningen på sykdomsaktiviteten målt i år 2. Forkortelser: KI, Konfidensintervall; M, Måned; N’, totalt antall pasienter i behandlingsgruppen med responsvariabel definert; NEDA-3, no evidence of disease activity
NEDA-3 (“No Evidence of Disease Activity”)
Ofatumumab økte sjansene for at ny-diagnostiserte, behandlingsnaïve pasienter å oppnå NEDA-3, både i første og andre året med behandling: Nærmere 9 av 10 pasienter oppnådde NEDA 3 i ofatumumab-gruppen versus nærmere 5 av 10 i teriflunomid-gruppen (Figur 1).2
Referanse
1. Hauser SL, et al. The Development of Ofatumumab, a Fully Human Anti-CD20 Monoclonal Antibody for Practical Use in Relapsing Multiple Sclerosis Treatment. Neurol Ther. 2023 Jul 14. doi: 10.1007/s40120-023-00518-0.
2. Gärtner J, et al. Efficacy and safety of ofatumumab in recently diagnosed, treatment-naive patients with multiple sclerosis: Results from ASCLEPIOS I and II. Mult Scler. 2022 Sep;28(10):1562-1575. doi: 10.1177/13524585221078825.
Hvilke pasienter er ▼Kesimpta (ofatumumab) kontraindisert hos?
Svar: Ofatumumab er kontraindisert hos personer med overfølsomhet overfor virkestoffet eller overfor noen av hjelpestoffene listet opp i pkt. 6.1 i SPCen, pasienter med alvorlig nedsatt immunforsvar, alvorlig aktiv infeksjon inntil bedring og kjent aktiv malignitet. Pasienter med aktiv hepatitt B skal ikke behandles med ofatumumab. HBV-screening av alle pasienter bør utføres før behandling igangsettes. Som et minimum bør screeningen omfatte testing av HBsAg (hepatitis B surface antigen) og HBcAb (hepatitis B core antibody). Dette kan suppleres med andre hensiktsmessige markører i henhold til lokale retningslinjer. Pasienter med positiv hepatitt B-serologi (HBsAg eller HBcAb) bør vurderes av en ekspert på leversykdommer før behandlingen igangsettes og bør overvåkes og behandles i henhold til lokale medisinske standarder for å forebygge reaktivering av hepatitt B.1
Referanse
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
Er ofatumumab assosiert med progressiv multifokal leukoencefalopati (PML)?
Svar: Per dato (august, 2023), er det ingen rapporterte saker med PML for ofatumumab innen multippel sklerose behandling.
Hos pasienter behandlet med anti-CD20-antistoffer, annen MS-behandling og ofatumumab ved betraktelig høyere doser for onkologiindikasjoner, har det vært observert infeksjon med John Cunningham (JC)-virus som førte til progressiv multifokal leukoencefalopati (PML), og legen bør derfor være oppmerksom på PML i anamnesen og på eventuelle kliniske symptomer eller MR-funn som kan tyde på PML. Ved mistanke om PML skal behandlingen med ofatumumab opphøre inntil man har utelukket PML.1
Referanse
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
Hvordan administreres ▼Kesimpta (ofatumumab)?
Svar: Ofatumumab ment for selvadministrering av pasienten ved subkutan injeksjon. Den første injeksjonen skal utføres under veiledning av tilstrekkelig opplært helsepersonell. De vanlige stedene for subkutane injeksjoner er mage, lår og ytterside av overarm. Anbefalt dose er 20 mg ofatumumab administrert ved subkutan injeksjon med: • innledende doser ved uke 0, 1 og 2 etterfulgt av påfølgende månedlige doser med start ved uke 4.1
Referanse
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
Hvordan skal en forholde seg til ▼Kesimpta (ofatumumab) ved graviditet?
Svar: Man anbefaler å seponere Kesimpta 6 måneder før man forsøker å bli gravid. (NB effektiv prevensjon i 6 mnd etter seponering). Det er begrenset mengde data på bruk av ofatumumab hos gravide kvinner. Ifølge funn fra dyrestudier kan ofatumumab passere placentabarrieren og forårsake føtal B-celledeplesjon. Forbigående perifer B celledeplesjon og lymfocytopeni er rapportert hos spedbarn til mødre som ble eksponert for andre anti CD20-antistoffer under svangerskapet. Behandling med ofatumumab bør unngås under svangerskap såfremt ikke den potensielle fordelen for moren oppveier den potensielle risikoen for fosteret.1
Referanse
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
Er det trygt å bruke ▼Kesimpta (ofatumumab) ved amming?
Svar: Bruk av ofatumumab hos ammende kvinner er ikke undersøkt. Hos mennesker utskilles IgG-antistoffer i brystmelken de aller første dagene etter fødselen, men konsentrasjonen blir raskt lav. En risiko for det diende barnet kan derfor ikke utelukkes i denne korte perioden. Ofatumumab brukes under amming dersom det er klinisk nødvendig. Dersom pasienten ble behandlet med ofatumumab inntil de siste månedene av svangerskapet, kan amming starte umiddelbart etter fødselen.1
Referanse
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
Hvordan bør en forholde seg til vaksinasjon når en skal starte med ▼Kesimpta (ofatumumab)?
Svar: All immunisering skal foretas i henhold til retningslinjer for immunisering. Levende eller levende, svekkede vaksiner skal gis minst 4 uker før oppstart med ofatumumab, og inaktiverte vaksiner skal om mulig gis minst 2 uker før oppstart med ofatumumab. Ofatumumab kan interferere med effekten til inaktiverte vaksiner. Sikkerheten ved immunisering med levende eller levende, svekkede vaksiner etter behandling med ofatumumab, er ikke undersøkt. Vaksinering med levende eller levende, svekkede vaksiner anbefales ikke under behandling eller før B-celletallet er gjenopprettet etter seponering. Median tid til B-celletallet er gjenopprettet til nedre normalgrense (LLN, definert som 40 celler/µl) eller baselinenivå er 24,6 uker etter seponering av behandlingen ut fra data fra fase III-studier.1
Referanse
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
Spørsmål: Hvordan administreres Kesimpta® (ofatumumab)?
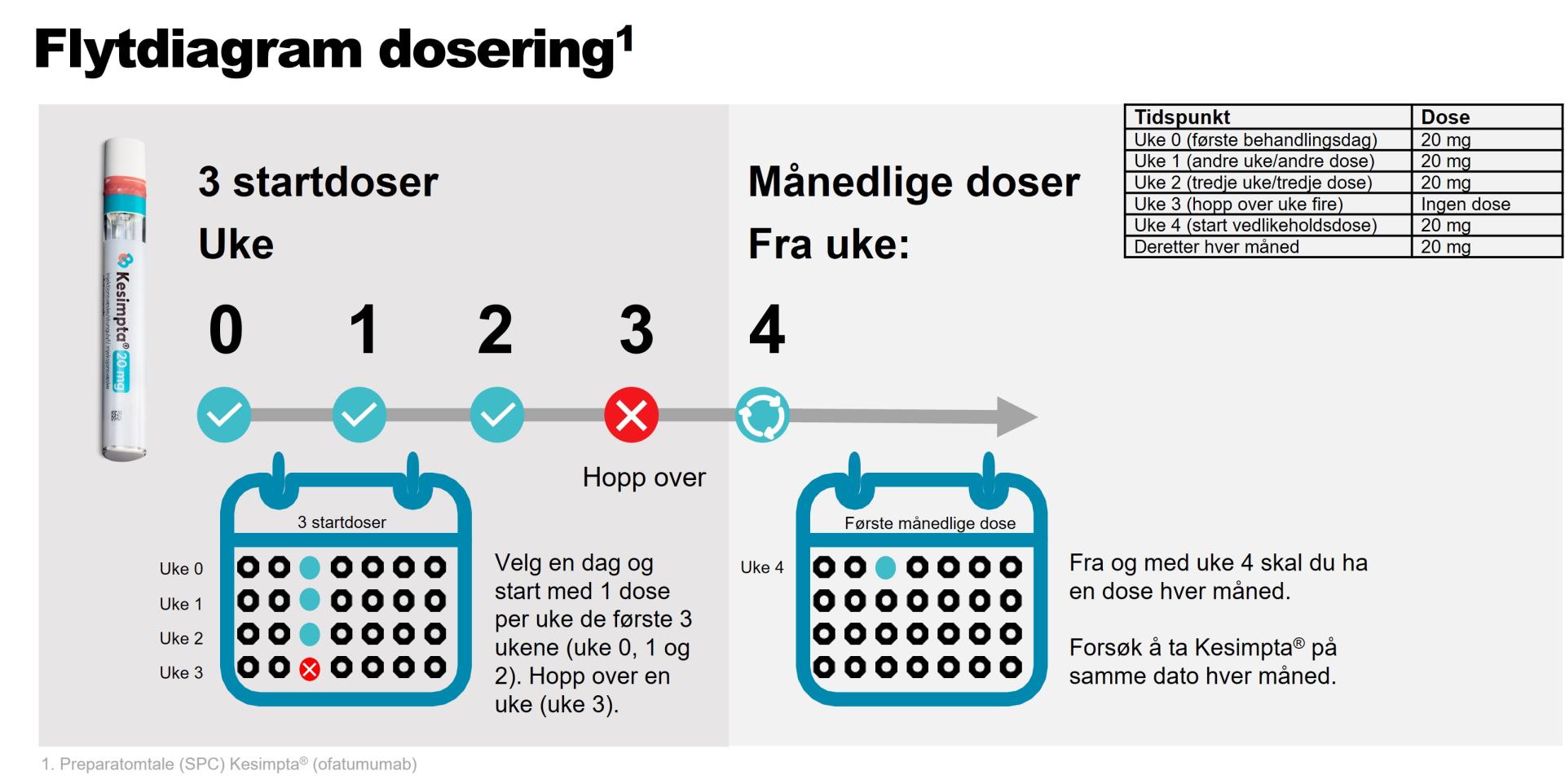
Svar: Kesimpta kommer med en 20 mg ferdigfylt Sensoready®-penn, som administreres av pasienten selv ved subkutan injeksjon. Vanlige områder for injeksjoner er mage, lår og ytterside av overarm. Den første injeksjonen skal utføres under veiledning av helsepersonell (SPC pkt 4.2). Pasientene bør informeres om at injeksjonsrelaterte reaksjoner (systemiske) kan forekomme, vanligvis i løpet av 24 timer og hovedsakelig etter første injeksjon.
Anbefalt dose er 20 mg som subkutan injeksjon med innledende doser ved uke 0, 1 og 2, etterfulgt av påfølgende månedlige doser med start ved uke 4 (se figur 1). Instruksjonsfilm for administrering av Kesimpta 20 mg ferdigfylt Sensoready®-penn kan sees på Felleskatalogen.no her: https://www.felleskatalogen.no/medisin/kesimpta-novartis-689975#instruks....
Figur 1: Illustrasjon dosering av Kesimpta® (ofatumumab). Anbefalt dose er 20 mg som subkutan injeksjon med innledende doser ved uke 0, 1 og 2, etterfulgt av påfølgende månedlige doser med start ved uke 4.
Referanse:
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
Spøsmål: Er det nødvendig med premedisinering ved administrering av Kesimpta?
Svar: I kliniske studier ved relapserende MS ble det kun sett begrenset nytte av premedisinering med steroider. Dersom det oppstår injeksjonsrelaterte reaksjoner, kan de håndteres med symptomatisk behandling. Premedisinering er derfor ikke nødvendig (SPC pkt 4.4).
Referanse:
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
Spørsmål: Hva gjør en om en glemmer en dose?
Svar: Dersom en injeksjon blir glemt, skal den administreres så snart som mulig uten å vente til neste planlagte dose. Påfølgende doser bør administreres med anbefalte intervaller (SPC pkt. 4.2)
Om ønskelig, kan en bruke doseringskort/skjema for å notere ned dato for administrering av injeksjonene. Dette kan lastes ned enten som vanlig PDF. Denne kan printes og fylles ut med penn her. Alternativt kan en laste ned en versjon der en kan skrive rett inn i PDFen og lagre lokalt på egen PC, som en finner her. Om en ønsker å få bestilt doseringskort i trykt versjon, vennligst ta kontakt med medisinsk avdeling i Novartis Norge, e-post: [email protected]
Referanser
1. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
2. Felleskatalogen. Kesimpta. Instruksjonfilmer og – brosjyrer [Internett] Felleskatalogen; . Tilgjengelig fra:https://www.felleskatalogen.no/medisin/kesimpta-novartis-689975#instruks...
Spørsmål: Hvor raskt ser en virkning av Kesimpta?
Svar: I de kliniske studiene på relapserende MS (ASCLEPIOS1 og APLIOS2), benyttet en 20 mg ofatumumab hver 4.uke, etter en initeringsfase på 20 mg ved dag 1, dag 7 og dag 14. Denne administeringen førte til en rask og vedvarende reduksjon av B-celler under nedre referansegrense (LLN, definer som 40 celler/ µL) så tidlig som to uker etter behandlingen ble initiert.1,2,3 Før initieringen av vedlikeholdsfasen i uke 4, så var totalt B-cellenivå <10 celler/ µL oppnådd hos 94% av pasientene, og økte til 98% av pasientene ved uke 12 (Figur 1). Dette ble opprettholdt så lenge som 120 uker (det vil si så lenge pasientene var under behandling).1,3
Figur 1: I fase 3 -studiene ASCLEPIOS, observerte en B-celledeplesjon så tidlig som to uker etter initiering. Figur utarbeidet av Novartis basert på Hauser et al.1
Referanse
-
Hauser SL, Bar-Or A, Cohen JA, et al; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
-
Bar-Or A, Wiendl H, Montalban X, et al.. Rapid and sustained B-cell depletion with subcutaneous ofatumumab in relapsing multiple sclerosis: APLIOS, a randomized phase-2 study. Mult Scler. 2022 May;28(6):910-924. doi: 10.1177/13524585211044479.
-
Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0