Utvalgt sikkerhetsinformasjon:
- I de pivotale studiene forekom bivirkninger på injeksjonsstedet hos henholdsvis 8,2 % og 1,8 % av pasientene på inklisiran og placebo.
- Forsiktighet ved alvorlig nedsatt lever- og/eller nyrefunksjon.
- Hemodialyse bør ikke utføres i minst 72 timer etter dosering med inklisiran.
Studiedesign:
ORION-8 var en 3-årig open-label forlengelsesstudie av de placebokontrollerte fase 3-studiene ORION-92, ORION-103 og ORION-113, og fase 2-studien ORION-34. Totalt ble 3274 pasienter inkludert i ORION-8, dette var voksne pasienter med etablert ASCVD, ASCVD risikoekvivalente* eller pasienter med heterozygot familiær hyperkolesterolemi, i tillegg til forhøyet LDL-C. Pasientene mottok subkutan injeksjon av 300 mg inklisirannatrium dag 1 etterfulgt av dag 90, og deretter hver 180. dag frem til dag 990. Studieslutt (end-of-study visit) var på dag 1080, dvs. 90 dager etter siste dose av inklisiran.
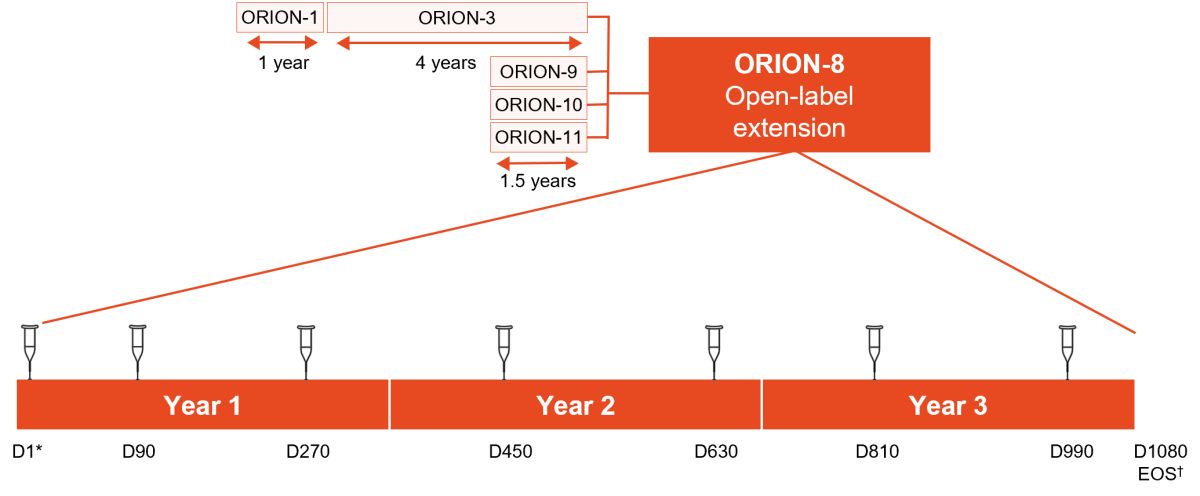
Når eksponeringstiden i inngangsstudiene medregnes, representerer ORION-8 mer enn 12 000 pasientårs eksponering for inklisiran. Flere enn 200 pasienter mottok inklisiran i mer enn seks år.
Endepunkter i studien:
- Det primære effektendepunktet var andel av pasienter som oppnådde prespesifiserte LDL-C målverdier i løpet av studien (ASCVD: <1,8 mmol/l, ASCVD risikoekvivalente: <2,6 mmol/l).
For å oppnå samsvar med reviderte LDL-C behandlingsmål i retningslinjer som ble oppdatert etter at studien ble designet, ble oppnåelse av LDL-C målverdier på <1,4 mmol/l for ASCVD og <1,8 mmol/l for ASCVD risikoekvivalente lagt til som en analyse i etterkant.
- Det primære sikkerhetsendepunktet var langtids sikkerhet og tolerabilitet
- Det sekundære effektendepunktet var prosentvis og absolutt endring i LDL-C ved studieslutt
Resultater – effekt:
- 78,4% av pasientene oppnådde de prespesifiserte LDL-C målverdiene i løpet av studieperioden (95% KI: 76,8; 80,0):
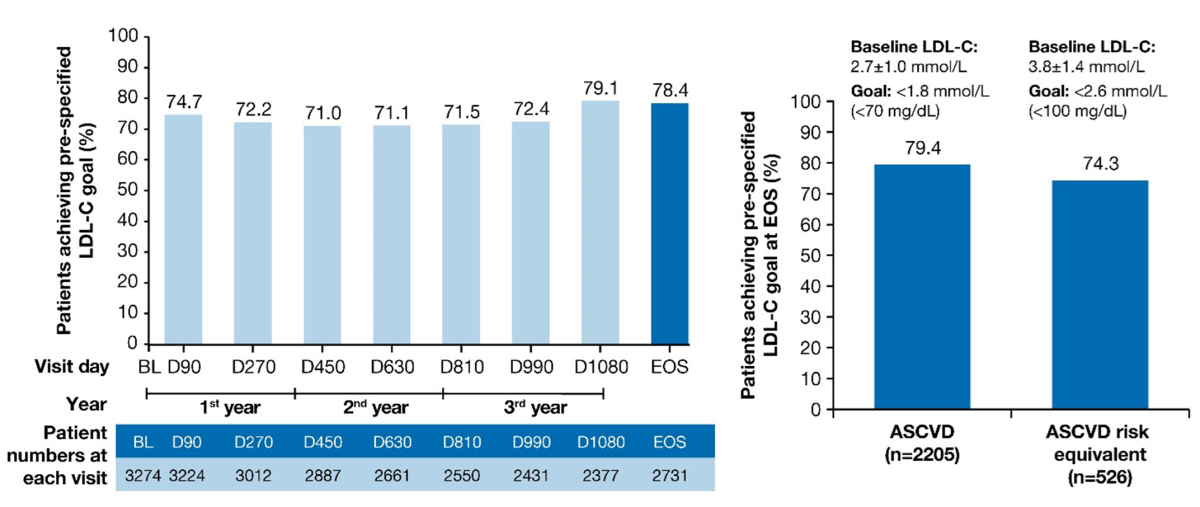
- Av pasienter med etablert ASCVD var det 66,3% som oppnådde det guideline-anbefalte LDL-C-behandlingsmålet på <1,4 mmol/l (95% KI: 64,2; 68,2) ved utgangen av studien.
- Av ASCVD risikoekvivalente pasienter var det 46,6% (95% KI: 42,3; 50,9) som oppnådde det guideline-anbefalte LDL-C-behandlingsmålet på <1,8 mmol/l ved utgangen av studien.
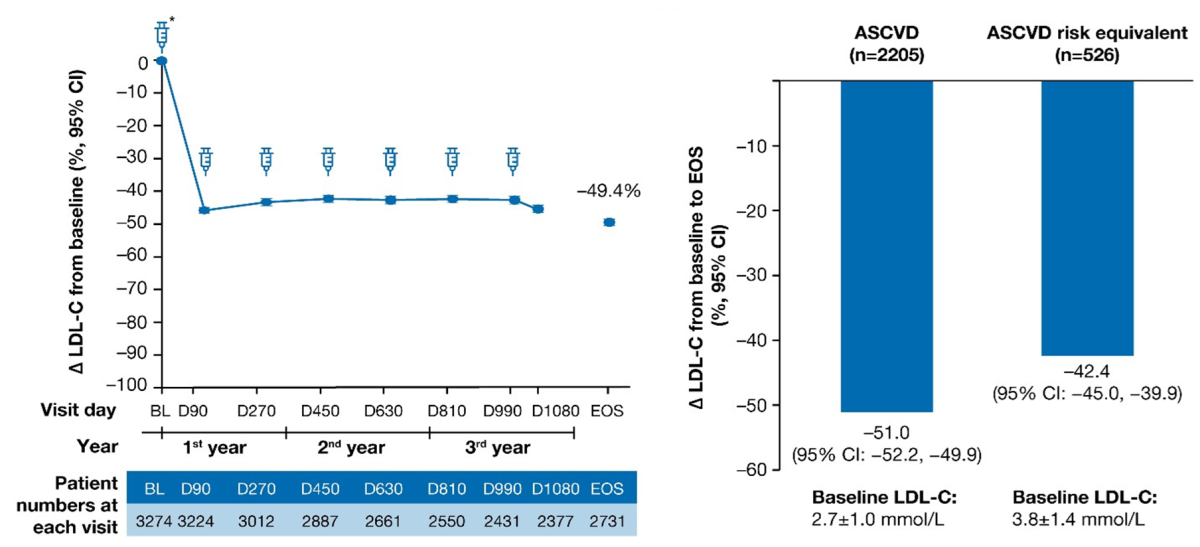
- Gjennomsnittlig LDL-C reduksjon ved studieslutt var -49,4% (95% KI: -50,4; -48,3):
Resultater – sikkerhet:
- Ingen nye sikkerhetssignaler ble observert i ORION-8-studien.
- De hyppigst rapporterte bivirkningene var COVID-19 (13,8%), ukontrollert diabetes mellitus (7%) og hypertensjon (7%).
- Bivirkninger på injeksjonsstedet (alle var milde eller moderate) oppsto hos 5,9% av pasientene. Dette samsvarer med observasjonene i de forutgående fase 3-studiene.
- Forekomst av behandlingsinduserte anti-drug antistoffer (ADAs) var lite frekvent (5,5%) og hadde ingen påvirkning på effekt i form av LDL-C-reduksjon eller sikkerhetsprofil.
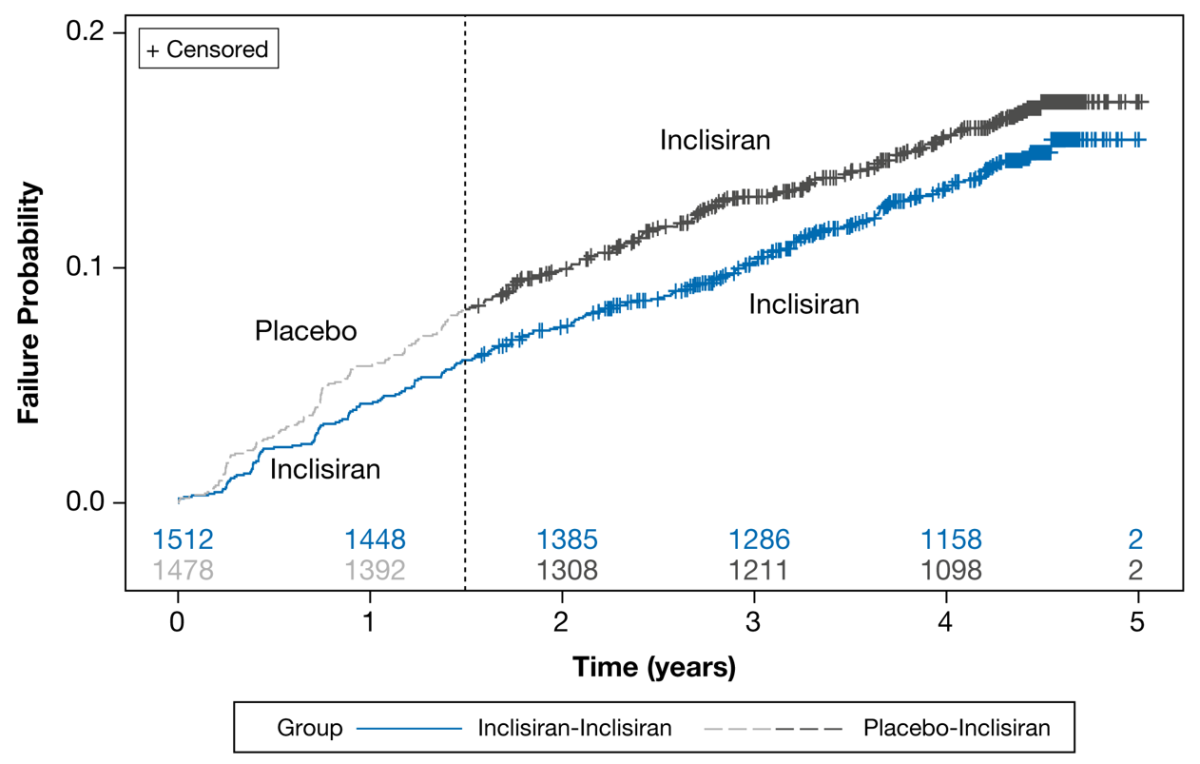
- Numerisk færre av pasientene som var randomisert til inklisiran i inngangsstudiene opplevde MACE-relaterte sikkerhetshendelser sammenliknet med pasienter som mottok placebo i inngangsstudiene: 217 (14,4%) av 1512 pasienter på inklisiran opplevde MACE-relaterte sikkerhetshendelser. I gruppen som mottok placebo i inngangsstudiene og skiftet til inklisiran i ORION-8, var det 241 (16,3%) av 1478 pasienter som opplevde MACE-relaterte sikkerhetshendelser (hazard ratio [95% CI]: 0.85 [0.71-1.03]; P=0.091).
- Selv om dette ikke er statistisk signifikante funn, kan observasjonene gi en indikasjon på at tidlig oppstart og vedvarende behandling med inklisiran kan ha en gunstig effekt når det gjelder MACE-relaterte sikkerhetshendelser.
ORION-8: Hovedpunkter:
- ORION-8 er den største kliniske studien på inklisiran til nå, og tilfører ytterligere evidens for langtidseffekt, sikkerhet og tolerabilitet for inklisiran i pasienter med høy eller svært høy kardiovaskulær risiko og forhøyet LDL-C, utover seks års behandlingsvarighet.
- ORION-8 viste at reduksjonen i LDL-C fra baseline gjennom de tre årene med open-label forlengelse, var konsistent med reduksjonen som ble observert i de forutgående placebo-kontrollerte fase 3-studiene over 18 måneder.
- Nær 80% av pasientene oppnådde prespesifiserte LDL-C behandlingsmål.
- Gjennomsnittlig endring i LDL-C ved studieslutt var -49,4%.
- ORION-8 viste en gunstig sikkerhets- og tolerabilitesprofil for inklisiran, konsistent med det som tidligere er rapportert. Injeksjonsstedsreaksjoner ble rapportert hos 5,9%.
Merknader:
*ASCVD risikoekvivalente var definert som enten type 2-diabetes, familiær hyperkolesterolemi, eller en 10-års risiko ≥ 20 % for en kardiovaskulær hendelse vurdert med Framingham Risk Score, i fravær av en medisinsk historikk med koronar hjertesykdom, cerebrovaskulær sykdom eller perifer arteriell sykdom.
Referanser:
- Wright RS, Raal FJ, Koenig W et al. Inclisiran administration potently and durably lowers LDL-C over an extended-term follow-up: the ORION-8 trial. Cardiovasc Res. 2024:cvae109. doi: 10.1093/cvr/cvae109.
- Raal F, Kallend D, Ray K, et al. Inclisiran for the Treatment of Heterozygous Familial Hypercholesterolemia. N Engl J Med. 2020;382(16):1520–1530.
- Ray K, Wright R, Kallend D, et al. Two Phase 3 Trials of Inclisiran in Patients with Elevated LDL Cholesterol. N Engl J Med. 2020;382(16):1507–1519.
- Ray KK, Troquay RP, Visseren FL, et al. Long-term efficacy and safety of inclisiran in patients with high cardiovascular risk and elevated LDL cholesterol (ORION-3): results from the 4-year open-label extension of the ORION-1 trial. The Lancet Diabetes & Endocrinology. 2023 Jan 5.
NO250605_11439979
Sikkerhet og tolerabilitet ved bruk av Leqvio over lang tid1
Studiedesign:
Dette er en post hoc-analyse med mål om å utvide og styrke evidensen for sikkerhet og tolerabilitet ved bruk av Leqvio (inklisiran) over lang tid.
Analysen inkluderte data fra ORION-12, -33, -54, -95, -106 og -116, samt ORION-87-studien. Totalt ble 3576 pasienter behandlet med Leqvio i disse syv studiene. Dette svarer til nær 10 000 pasientårs eksponering, eller 20 000 injeksjoner. Varigheten av Leqvio-eksponeringen var for enkelte pasienter opptil seks år. Flere enn 1500 pasienter ble behandlet med Leqvio i mer enn tre år.
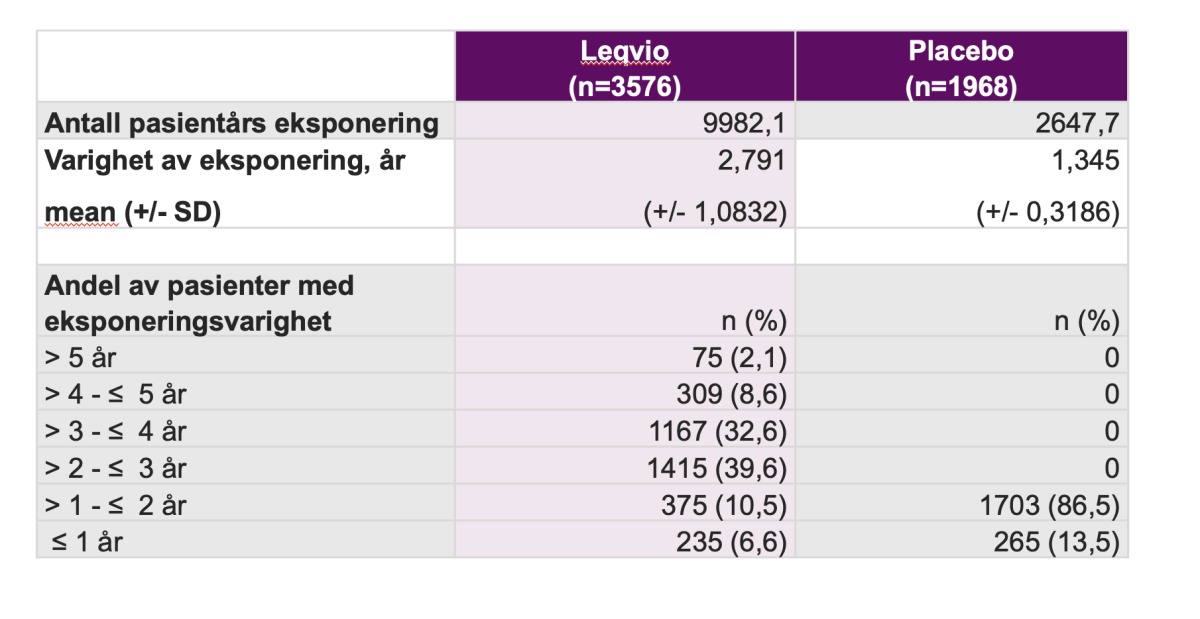
Endepunkter:
Endepunkter i denne samlede analysen inkluderte kumulert insidens i løpet av en tidsperiode på opp til seks år og eksponeringsjusterte insidensrater (EAIR) for:
- Alvorlige bivirkninger oppstått under studiens varighet
- Bivirkninger som førte til behandlingsavbrudd
- Medisinsk relevante bivirkninger:
- Lever-, muskel- og nyrerelaterte hendelser
- Nyoppstått diabetes
- MACE-hendelser, som inkluderte kardiovaskulær død, hjertestans, ikke-fatalt hjerteinfarkt og ikke-fatalt hjerneslag
- Endringer i relaterte laboratorieparametre
- Forekomst av behandlingsinduserte anti-drug-antistoffer
Statistisk metode:
Sikkerhetsanalysen ble gjennomført ved bruk av deskriptiv statistikk fra sikkerhetsdatabasen til hver studie, som inkluderte alle pasienter som mottok minst 1 dose med inklisiran eller placebo. Antall og prosentandel av pasienter som hadde minst en bivirkning, og EAIR med 95 % konfidensintervall ble rapportert for bivirkninger i løpet av studietiden. EAIR beskrives per 100 pasientår.
Resultater:
Bivirkninger på injeksjonsstedet forekom hyppigere med Leqvio (9,3%) sammenliknet med placebo (1,8%). Dette samsvarer med resultater fra tidligere publiserte fase 3-studier over 18 måneder.5,6
Kaplan-Meier-analyse viste at forekomsten av alvorlige bivirkninger eller bivirkninger som førte til behandlingsavbrudd, lever-, muskel- og nyrehendelser, nyoppstått diabetes, forhøyet kreatinkinase eller kreatinin var balanserte mellom Leqvio- og placeboarmene.
Differanser i EAIR mellom Leqvio- og placeboarmene for de viktigste endepunktene er illustrert i søylediagrammet under.
Eksponeringsjusterte insidensrater (EAIR) for MACE-hendelser rapportert som bivirkninger var numerisk lavere i Leqvio-armen sammenliknet med placeboarmen, henholdsvis 3,79 (95 % KI: 3,41-4,20) vs. 6,75 (95 % KI: 5,79-7,83) per 100 pasientår. Dette utgjør en differanse i EAIR på -2,96 (95 % KI: -4,10 til -1,94).
Behandlingsinduserte anti-drug-antistoffer var sjeldne (4,6 %), få av disse var persistente (1,4%) og de var ikke assosiert med økt forekomst av alvorlige bivirkninger eller bivirkninger som førte til behandlingsavbrudd.
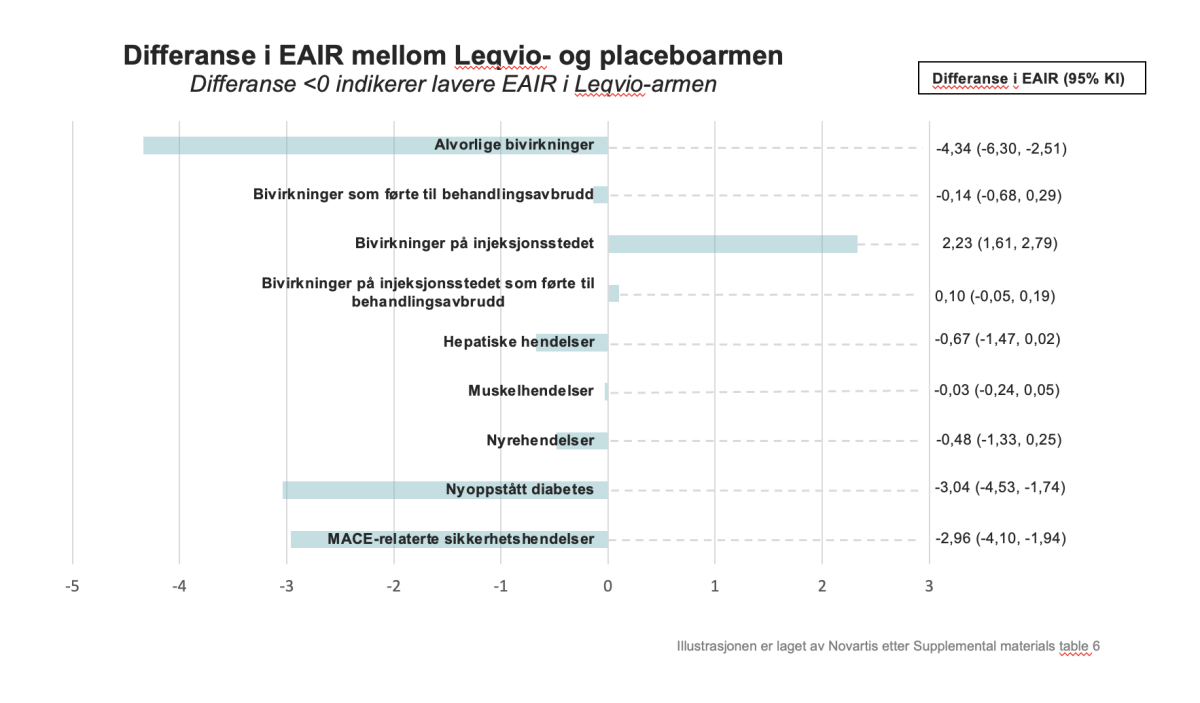
For visualisering av resultatene i form av Kaplan-Meier-kurver henviser vi til originalpublikasjonen, som kan leses her: Safety and Tolerability of Inclisiran for Treatment of Hypercholesterolemia in 7 Clinical Trials | Journal of the American College of Cardiology (jacc.org)
Studiebegrensninger:
Resultatene er fremkommet gjennom samlede data fra ulike kliniske studier med spesifikke inklusjonskriterier, og vil derfor muligens ikke gjenspeile en generell befolkning. Selv om eksponeringsjusterte insidensrater ble kalkulert, er det ikke mulig å gjøre en direkte sammenlikning av hendelser mellom Leqvio og placebo utover de første 1,5 årene. Det var få pasienter som mottok Leqvio i mer enn fire år.
Konklusjon:
Denne post hoc-analysen indikerer at langtids bruk av Leqvio er trygg og generelt godt tolerert i de studerte populasjonene.
Resultatene samsvarte med funn i tidligere fase 3-studier5,6. Det fremkom ingen nye sikkerhetssignaler i denne analysen.
Det var en lavere rate av MACE-hendelser rapportert som bivirkninger i Leqvio-armen sammenliknet med placeboarmen. Effekt av Leqvio på kardiovaskulære endepunkter er ikke fastslått, og avventer resultatene fra de pågående langtidsstudiene, ORION-48 og Victorion-2-Prevent.9
Analysen understøtter og forsterker de allerede foreliggende data om sikkerhet ved bruk av Leqvio.
Ønsker du å få mer informasjon om eller snakke mer om disse resultatene, ta gjerne kontakt med oss på [email protected]
Referanser:
-
Wright, R. S., Koenig, W., Landmesser, U., et al (2023). Safety and tolerability of inclisiran for treatment of hypercholesterolemia in 7 clinical trials. Journal of the American College of Cardiology, 82(24), 2251-2261
-
Ray, K. K., Landmesser, U., Leiter, L. A., et al (2017). Inclisiran in patients at high cardiovascular risk with elevated LDL cholesterol. New England Journal of Medicine, 376(15), 1430-1440.
-
Ray KK, Troquay RP, Visseren FL, et al. Long-term efficacy and safety of inclisiran in patients with high cardiovascular risk and elevated LDL cholesterol (ORION-3): results from the 4-year open-label extension of the ORION-1 trial. The Lancet Diabetes & Endocrinology. 2023 Jan 5.
-
Raal, F., Durst, R., Bi, R., et al (2023). Efficacy, Safety, and Tolerability of Inclisiran in Patients With Homozygous Familial Hypercholesterolemia: Results From the ORION-5 Randomized Clinical Trial. Circulation.
-
Raal, F. J., Kallend, D., Ray, K. K., et al. Inclisiran for the treatment of heterozygous familial hypercholesterolemia. New England Journal of Medicine, 2020, 382.16: 1520-1530.
-
Ray, K. K., Wright, R. S., Kallend, D., et al. Two phase 3 trials of inclisiran in patients with elevated LDL cholesterol. New England Journal of Medicine, 2020, 382.16: 1507-1519.
-
ClinicalTrials.gov. NCT03814187. Accessed December 21, 2023. https://clinicaltrials.gov/study/NCT03814187
-
ClinicalTrials.gov. NCT03705234. Accessed December 21, 2023 https://clinicaltrials.gov/study/NCT03705234
-
ClinicalTrials.gov. NCT05030428. Accessed December 21, 2023 https://clinicaltrials.gov/study/NCT05030428
NO250605_11439979
Studiedesign:1
ORION-3 var en open-label, ikke-randomisert forlengelsesstudie av fase-2 studien ORION-1. ORION-3 inkluderte 2 behandlingsarmer: inklisiran-only armen og switching-armen. Det var pasienter som hadde fylt 18 år og eldre, som enten hadde etablert ASCVD eller var høy-risiko pasienter som trengte primærprevensjon (definert som enten type-2 diabetes, familiær hyperkolesterolemi, eller en 10-års risiko for kardiovaskulære hendelser over 20 %), i tillegg til en forhøyet LDL-kolesterolverdi (≥1,8 mmol/l for ASCVD pasienter eller ≥2,6 mmol/l for høy-risiko primærprevensjon pasienter) til tross for høyeste tolererbare dose statin, og som hadde fullført ORION-1 studien som ble invitert til å delta. Det var til slutt 233 pasienter i inklisiran-only armen, og 80 pasienter i switching-armen som fullførte hele 4-års oppfølgingen i studien.1,4
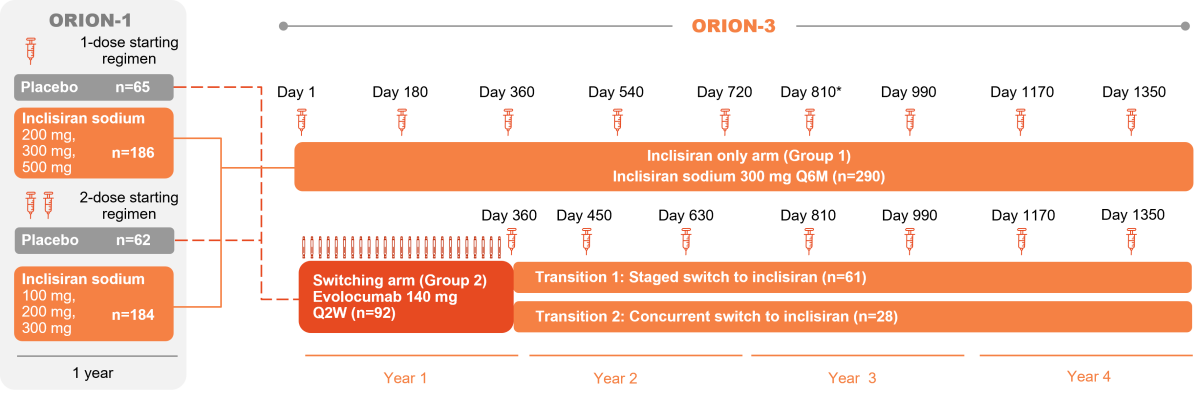
Endepunkter:
Det primære endepunktet i studien var prosentvis endring i LDL-C fra baseline (Dag 1 i ORION-1) til dag 210 i ORION-3, svarende til ca. 570 dagers eksponering for inklisiran. LDL-C nivåer ble fulgt til dag 1440 (dvs. 4 år). Langtidssikkerhet og -tolerabilitet var et sekundært endepunkt i studien. Et annet sekundært endepunkt var individuell respons på inklisiran definert ved andelen av pasienter i inklisiran-only armen som oppnådde følgende prespesifiserte LDL-C terskelverdier på et tidspunkt i løpet av studien: <2,6 mmol/l, <1,8 mmol/l, <1,3 mmol/l og <0,6 mmol/l.1
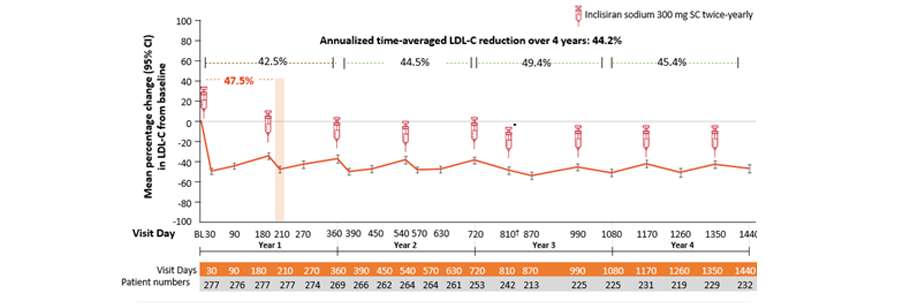
Resultater – effekt:
Pasienter behandlet med Leqvio oppnådde en gjennomsnittlig LDL-C reduksjon på 47,5 % fra baseline (dag 1 i ORION-1) til dag 210 i ORION-3 (95 % Cl:-50,69,-44,27; p<0,0001). LDL-C reduksjonen vedvarte gjennom hele studieperioden, gjennomsnittlig årlig LDL-C reduksjon over 4 år var 44,2 %.1
Videre fant man at 79% av pasientene i inklisiran-only armen oppnådde LDL-C nivåer på < 1,8 mmol/l og 62 % nådde LDL-C <1,3 mmol/l på et tidspunkt underveis i studieperioden.1
Resultater – sikkerhet:
Studien viste at behandling med Leqvio gjennom fire år var godt tolerert, med en sikkerhetsprofil som var konsistent med funn i de forutgående fase-3 studiene over 18 måneder.1,2,3 De vanligste behandlingsrelaterte bivirkningene var generell sykdomsfølelse og reaksjoner på injeksjonsstedet. Reaksjonene på injeksjonsstedet var alt overveiende milde til moderate og forbigående, dette er i samsvar med tidligere studier.1,2,3
ORION-3 – Begrensninger med studien:
- Dette var en open-label studie uten placebo kontrollgruppe
- Frivillig inkludering av pasienter kan potensielt ha introdusert en seleksjonsbias
- Pasienter i inklisiran-only armen mottok to årlige doser inklisiran uten oppstartsdose nr. to etter 90 dager, dette er ikke i samsvar med det godkjente doseringsregimet for inklisiran
ORION-3 – Nøkkelpunkter:
- Dette er den første prospektive langtidsstudien som demonstrerer at inklisiran, gitt to ganger per år som tillegg til statinbehandling, gir en effektiv og vedvarende reduksjon av LDL-C nivåer over fire års behandlingstid.1
- Omtrent 80% av pasientene oppnådde et LDL-C nivå < 1,8 mmol/L på et tidspunkt underveis i studien.1
- Inklisiran var godt tolerert over studieperioden på 4 år.1
- Dette er den lengste Leqvio oppfølgingsstudie til nå, og demonstrerer at nytte/risiko-profilen er konsistent med funnene i de forutgående fase-3 studiene over 18 måneder.1,2,3
Referanser:
-
Ray KK, Troquay RP, Visseren FL, et al. Long-term efficacy and safety of inclisiran in patients with high cardiovascular risk and elevated LDL cholesterol (ORION-3): results from the 4-year open-label extension of the ORION-1 trial. The Lancet Diabetes & Endocrinology. 2023 Jan 5.
-
Ray K, Wright R, Kallend D, et al. Two Phase 3 Trials of Inclisiran in Patients with Elevated LDL Cholesterol. N Engl J Med. 2020;382(16):1507–1519.
-
Raal F, Kallend D, Ray K, et al. Inclisiran for the Treatment of Heterozygous Familial Hypercholesterolemia. N Engl J Med. 2020;382(16):1520–1530.
-
ORION-1 (NCT02597127). Trial to Evaluate the Effect of ALN-PCSSC Treatment on Low Density Lipoprotein Cholesterol (LDL-C). Available at: https://clinicaltrials.gov/ct2/show/NCT02597127
NO250605_11439979
Studiedesign:1
ORION-9 var en internasjonal, dobbeltblindet, randomisert, placebokontrollert multisenterstudie over 18 måneder hos 482 pasienter med heterozygot familiær hyperkolesterolemi (HeFH). Alle pasientene brukte maksimalt tolererte doser med statiner med eller uten annen lipidmodifiserende behandling, som ezetimib, og hadde behov for ytterligere LDL-C-reduksjon.
Primære endepunkt:2
- prosentvis endring i LDL-C fra baseline til dag 510 sammenlignet med placebo, og
- tidsjustert prosentvis endring i LDL-C fra baseline etter dag 90 og opp til dag 540 sammenliknet med placebo
Hovedfunnene i ORION-9 studien er visualisert i denne videoen:
NO241024_11282398
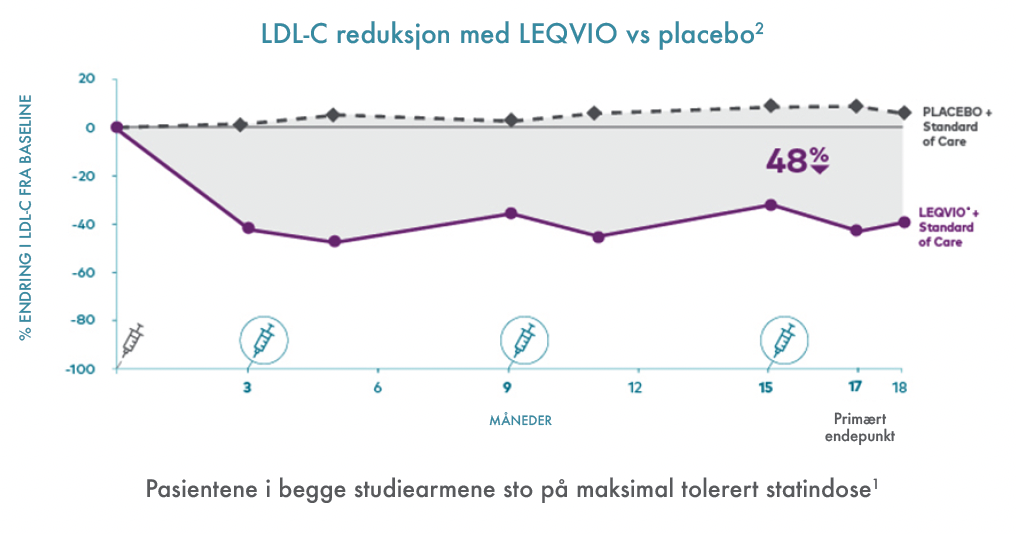
I ORION-9 studien ga LEQVIO®:2
-
48 % LDL-C reduksjon sammenliknet med placeboarmen ved dag 510 (17 måneder) (95 % KI: -54 %, -42 %; p < 0,0001).
-
44 % tidsjustert prosentvis LDL-C reduksjon sammenliknet med placeboarmen etter dag 90 (3 måneder) og opp til dag 540 (18 måneder) (95 % KI: -48 %, -40 %; p < 0,0001).
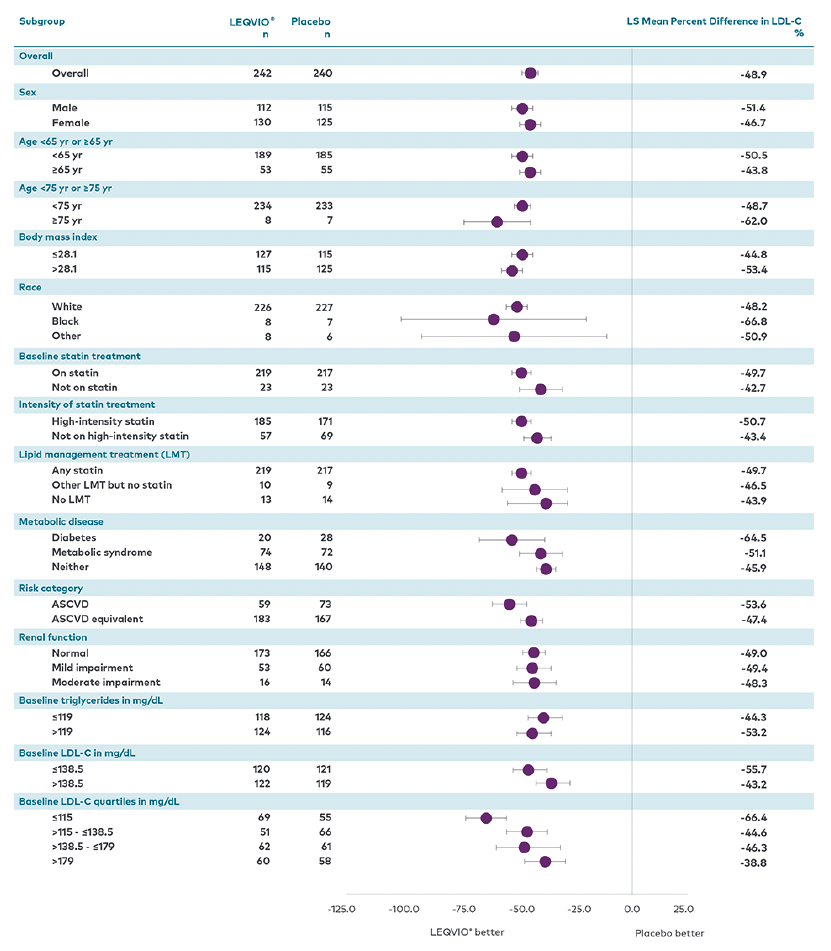
Reduksjon av LDL-C for predefinerte undergrupper i ORION-9:2
Det ble sett konsistent og statistisk signifikant (p < 0,05) prosentvis endring i LDL-C fra baseline til dag 510 og tidsjustert prosentvis endring i LDL-C fra baseline etter dag 90 og opp til dag 540 i alle undergrupper uavhengig av demografi ved baseline, sykdomskarakteristikker ved baseline (inkludert kjønn, alder, kroppsmasseindeks, etnisitet og statinbruk ved baseline), komorbiditeter og geografiske regioner.1,2
Referanser:
1. Leqvio SPC avsnitt 4.4, 4.8 og 5.1
2. Raal FJ, Kallend D, Ray KK, et al; ORION-9 Investigators. Inclisiran for the treatment of heterozygous familial hypercholesterolemia. N Engl J Med. 2020;1:1-11. doi: 10.1056/NEJMoa1913805
Studiedesign:2
Det ble utført to studier hos pasienter med ASCVD og pasienter med tilsvarende risiko (ORION-10 og ORION-11). Pasientene sto på maksimal tolerert dose med statiner med eller uten annen lipidmodifiserende behandling, som ezetimib, og hadde behov for ytterligere LDL-C-reduksjon.
ORION-10 var en dobbeltblindet, randomisert, placebokontrollert multisenterstudie over 18 måneder utført hos 1561 pasienter med ASCVD.
ORION-11 var en internasjonal, dobbeltblindet, randomisert, placebokontrollert multisenterstudie over 18 måneder som evaluerte 1617 pasienter med ASCVD eller tilsvarende risiko.
Primære endepunkt i begge studiene:
- prosentvis endring i LDL-C fra baseline til dag 510 sammenliknet med placebo, og
- tidsjustert prosentvis endring i LDL-C fra baseline etter dag 90 og opp til dag 540 sammenliknet med placebo
Hovedfunnene i ORION-10 og -11 studiene er visualisert i denne videoen:
NO2310318221
Full sikkerhetstekst for Leqvio finnes her: Leqvio «Novartis» - Felleskatalogen
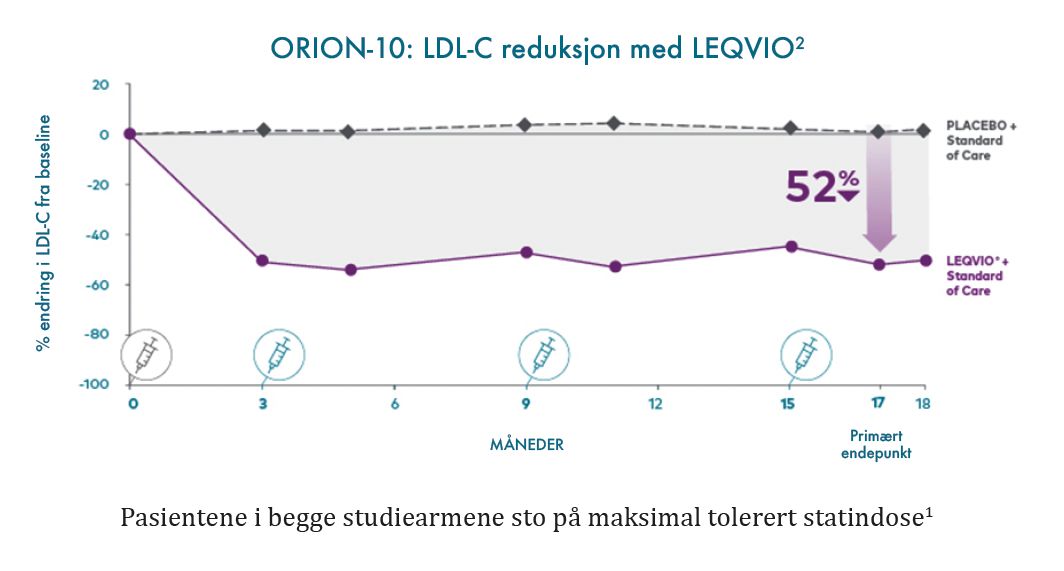
I ORION-10 studien ga LEQVIO®:2
- 52 % LDL-C reduksjon sammenliknet med placeboarmen ved dag 510 (17 måneder) (95 % KI: -56 %, -49 %; p < 0,0001).
- 54 % vedvarende LDL-C reduksjon sammenliknet med placeboarmen etter dag 90 (3 måneder) og opp til dag 540 (18 måneder) (95 % KI: -56 %, -51 %; p < 0,0001).
I ORION-11 studien ga Leqvio:2
- 50 % gjennomsnittlig reduksjon i LDL-C fra baseline til dag 510 sammenliknet med placebo (95 % KI: -53 %, -47 %; p < 0,0001).
- 49 % tidsjustert prosentvis reduksjon i LDL-C fra baseline etter dag 90 og opp til dag 540 sammenliknet med placebo (95 % KI: -52 %, -47 %; p < 0,0001).
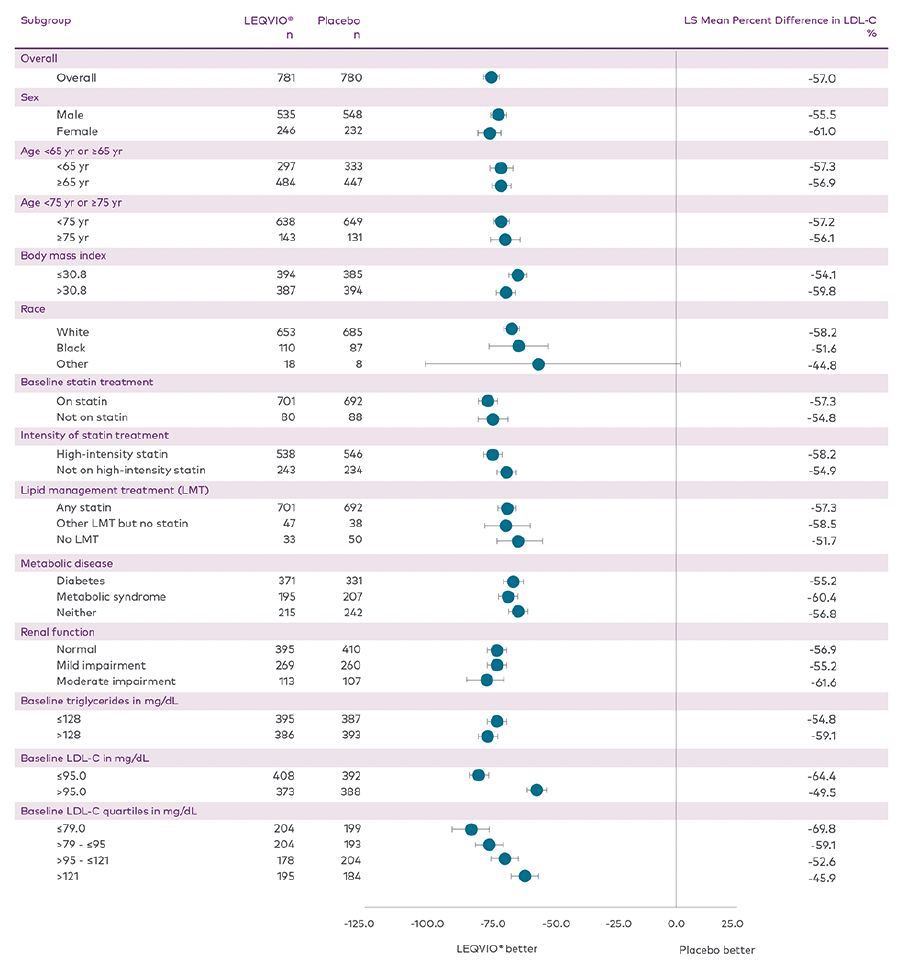
LDL-C reduksjon for predefinerte undergrupper i ORION-102
LEQVIO ga konsistente og statistisk signifikante LDL-C reduksjoner over et bredt spekter av undergrupper av pasienter.1,2
Ønsker du mer informasjon om studieprogrammet for LEQVIO?
Last ned ORION-10 faktaark her
Last ned ORION-11 faktaark her

